11.下列离子方程式正确的是( )
| A. | Zn和稀硝酸反应 Zn+2H+═Zn2++H2↑ | |
| B. | 鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 制备氢氧化铁胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| D. | Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O |
10.在不用指示剂的条件下,欲将含有盐酸的氯化钡溶液由酸性变为中性,选用的最佳试剂是( )
| A. | 氢氧化钡溶液 | B. | 硝酸银溶液 | C. | 碳酸钡粉末 | D. | 生石灰粉末 |
9.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用烧碱溶液吸收尾气中少量二氧化碳:OH-+CO2═HCO3- | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 小苏打溶液中加入过量石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O |
8.“嫦娥一号”探测器所用的镍氢蓄电池,其负极板材料M为能吸收氢原子的合金.充电时电极反应分别为:M+H2O+e-=MH+OH-,Ni(OH)2+OH--e-=NiOOH+H2O.下列有关镍氢蓄电池的说法正确的是( )
| A. | 放电时,正极附近的pH减小 | |
| B. | 放电时,总反应为MH+NiOOH=M+Ni(OH)2 | |
| C. | 充电时,电极M应与充电电源正极相连 | |
| D. | 充电后,负极板材料M变成了MH,MH中H元素显-1价 |
7.某化工厂冶炼金属、回收硫的工艺流程如图甲:
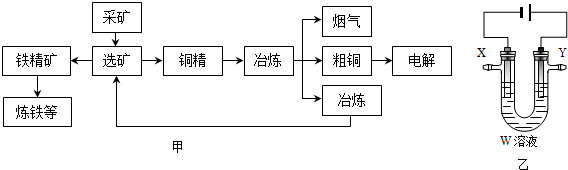
Ⅰ.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图乙所示.下列说法不正确的是B.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
铜盐溶液中Fe2,Zn2+对精炼铜可能会产生影响.工业上,除去Fe2+方法是,在酸性混合溶液中加入双氧水(选填:双氧水、次氯酸钠、氯水或高锰酸钾溶液)将Fe2+氧化成Fe3+,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.加入碱调节溶液pH范围为3.7<pH<4.6.

Ⅰ.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图乙所示.下列说法不正确的是B.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
6.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列化合物中符合上述条件的是( )
| A. | Na2O2 | B. | CaO | C. | FeCl2 | D. | SiO2 |
5.对于下列反应的反应类型的判断,不正确的是( )
| A. | CO2+H2O═H2CO3 化合反应 | |
| B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O 分解反应 | |
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 置换反应 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3 复分解反应 |
4.下列物质的化学式与名称、分类完全相符的是( )
| A. | 酒精、CH3OH、有机物 | B. | 硝酸钠、NaNO3、盐 | ||
| C. | 氧化铁、Fe3O4、氧化物 | D. | 纯碱,NaOH、碱 |
3.学习化学要准确掌握化学基本概念和研究方法.按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
找出上述三组分类中的错误,错误物质的化学式为Na2CO3、Al2O3.
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是D(填代号)
A.NaOH B.AgNO3 C.HCl D.Na2SO4
(3)配平下面化学方程式,回答下列问题:
3C+2K2Cr2O7+8H2SO4═2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
①H2SO4在上述反应中表现出来的性质是(填选项编号)C.
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.48L.
(4)在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,按要求回答下列问题:
该变化的基本反应类型是分解反应,Q物质的作用为催化剂.
0 173324 173332 173338 173342 173348 173350 173354 173360 173362 173368 173374 173378 173380 173384 173390 173392 173398 173402 173404 173408 173410 173414 173416 173418 173419 173420 173422 173423 173424 173426 173428 173432 173434 173438 173440 173444 173450 173452 173458 173462 173464 173468 173474 173480 173482 173488 173492 173494 173500 173504 173510 173518 203614
(1)下列是某同学对有关物质进行分类的列表:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO2 |
| 第三组 | NaOH | CH3COOOH | CaF2 | Al2O3 | SO2 |
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是D(填代号)
A.NaOH B.AgNO3 C.HCl D.Na2SO4
(3)配平下面化学方程式,回答下列问题:
3C+2K2Cr2O7+8H2SO4═2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
①H2SO4在上述反应中表现出来的性质是(填选项编号)C.
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.48L.
(4)在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,按要求回答下列问题:
| 物质 | M | N | Q | P |
| 反应前质量(g) | 50 | 1 | 3 | 12 |
| 反应后质量(g) | X | 26 | 3 | 30 |