题目内容
9.下列离子方程式正确的是( )| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用烧碱溶液吸收尾气中少量二氧化碳:OH-+CO2═HCO3- | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 小苏打溶液中加入过量石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O |
分析 A.稀硫酸具有弱氧化性,能将铁氧化为亚铁离子;
B.二氧化碳少量时,NaOH和二氧化碳反应生成碳酸钠和水;
C.电荷不守恒、转移电子不守恒;
D.小苏打中加入过量石灰水,二者反应生成碳酸钙、NaOH和水.
解答 解:A.稀硫酸具有弱氧化性,能将铁氧化为亚铁离子,离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.二氧化碳少量时,NaOH和二氧化碳反应生成碳酸钠和水,离子方程式为2OH-+CO2═CO32-+H2O,故B错误;
C.电荷不守恒、转移电子不守恒,离子方程式为Cu+2Ag+═Cu2++2Ag,故C错误;
D.小苏打中加入过量石灰水,二者反应生成碳酸钙、NaOH和水,离子方程式为Ca2++HCO3-+OH-═CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查离子方程式正误判断,为高频考点,涉及氧化还原反应、复分解反应,注意BD中离子反应与反应物的量有关,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.请参考题中图表,已知E1=134kJ•mol-1、E2=368kJ•mol-1,根据要求回答问题:

(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2 (g)+CO (g)═CO2 (g)+NO (g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应热化学方程式如下:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)═H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH (g)+$\frac{3}{2}$O2 (g)═CO2 (g)+2 H2O (l)△H=-764.7 kJ•mol-1.
(3)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为d kJ•mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=$\frac{1}{4}$(d+6a+5c-12b) kJ•mol-1(用含a、b、c、d的代表数式表示).

(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2 (g)+CO (g)═CO2 (g)+NO (g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应热化学方程式如下:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)═H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH (g)+$\frac{3}{2}$O2 (g)═CO2 (g)+2 H2O (l)△H=-764.7 kJ•mol-1.
(3)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
17.已知,T℃温度下,反应:N2(g)+3H2(g)?2NH3(g)△H<0的平衡常数K=9.向容积固定的某真空容器中充入N2(g)、H2(g)和NH3(g),使其浓度分别为3mol/L、1mol/L和50mol/L,在T℃温度下发生上述反应.下列说法中正确的是( )
| A. | 反应开始后,反应要放出能量 | |
| B. | 建立平衡状态时c(N2)<3 mol/L | |
| C. | 该条件下,平衡时N2的体积分数为$\frac{1}{14}$ | |
| D. | 反应条件变化时,其K值也一定发生变化 |
4.下列物质的化学式与名称、分类完全相符的是( )
| A. | 酒精、CH3OH、有机物 | B. | 硝酸钠、NaNO3、盐 | ||
| C. | 氧化铁、Fe3O4、氧化物 | D. | 纯碱,NaOH、碱 |
14.下列反应中,电子转移发生在同种元素之间的是( )
| A. | 2H2S+SO2═3S+2H2O | B. | Fe+Cu2+═Fe2++Cu | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
19.中学常见的某反应的化学方程式为a+b→c+d+H2O (未配平,反应条件略去).下列叙述不正确的是( )
| A. | 若a是铁,b是稀硝酸(过量)且a可溶于c溶液中.则a与b反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O═4H++SO${\;}_{4}^{2-}$+2Br- | |
| C. | 若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20 g.mol-'1的混合气体进行喷泉实验.假设溶质不扩散,实验完成后所得溶液的物质的量浓度约为0. 056 mol.L-1 | |
| D. | 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-═CO${\;}_{3}^{2-}$+3HCO${\;}_{3}^{-}$+H2O |

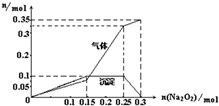 学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.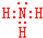 ,空间构型为三角锥形.
,空间构型为三角锥形.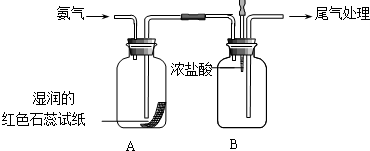 某小组同学利用如图所示装置探究氨气的性质.
某小组同学利用如图所示装置探究氨气的性质.