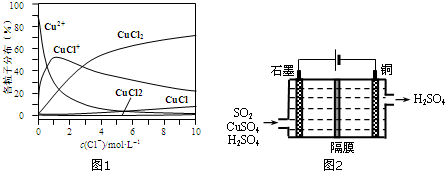
4.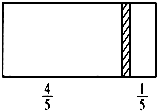 一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )
一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )
 一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )
一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )| A. | 右边CO与CO2分子数之比为1:3 | |
| B. | 右侧气体密度是相同条件下氢气密度的18倍 | |
| C. | 右侧CO的质量为1.75g | |
| D. | 若隔板处于距离右端$\frac{1}{6}$处,其他条件不变,则前后两次压强之比为25:24 |
20.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾(FeSO4•7H2O),设计了如下流程,下列说法不正确的是( )
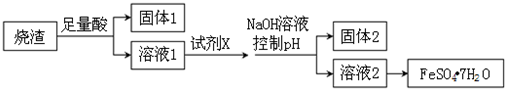

| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
18.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.
实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是 ( )
0 173255 173263 173269 173273 173279 173281 173285 173291 173293 173299 173305 173309 173311 173315 173321 173323 173329 173333 173335 173339 173341 173345 173347 173349 173350 173351 173353 173354 173355 173357 173359 173363 173365 173369 173371 173375 173381 173383 173389 173393 173395 173399 173405 173411 173413 173419 173423 173425 173431 173435 173441 173449 203614
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量 变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 0 | 0 | 2 | 吸收热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | 热量关系:a+b=92.4 | B. | 三个容器内反应的平衡常数:③>①=② | ||
| C. | 平衡时氨气的体积分数:①=②>③ | D. | ①N2的转化率+②NH3的转化率=100% |
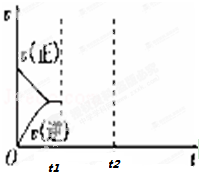 高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)?Fe(s)+CO2(g);正反应吸热
高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)?Fe(s)+CO2(g);正反应吸热