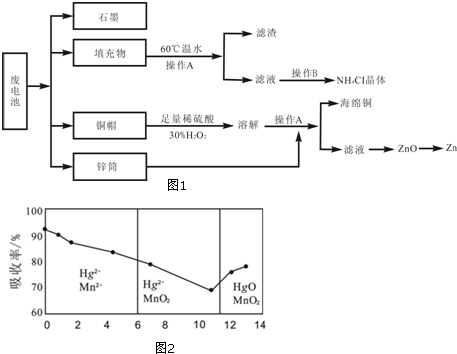
��Ŀ����
20��ijͬѧ������������ȡ������������Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3���������������ʣ���ȡ�̷���FeSO4•7H2O����������������̣�����˵������ȷ���ǣ�������
| A�� | �ܽ�����ѡ���������ᣬ�Լ�Xѡ������ | |
| B�� | ����1��һ������SiO2������pH��Ϊ��ʹAl3+ת��ΪAl��OH��3���������2 | |
| C�� | ���ı䷽��������Һ1��ֱ�Ӽ�NaOH���������õ��ij����������ܽ⣬����Һ���ᾧ����Ҳ�ɵõ�FeSO4•7H2O | |
| D�� | ����Һ2�õ�FeSO4•7H2O��Ʒ�Ĺ����У������������ֹ�������ͷֽ� |
���� ��������ȡ������������Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3���������������ʣ���������м����������ᣬFe2O3��Al2O3���ᷴӦ���ɵ������������������������費��Ӧ�����ˣ�����1Ϊ�������裻����Һ�м������۽������ӻ�ԭΪ�������ӣ�����pHֵʹ��������ȫ���������������������ˣ�����2Ϊ������������Һ2Ϊ��������������Ũ������ȴ�ᾧ�����ˣ��õ������������壬�Դ˽��н��
��� �⣺��������ȡ������������Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3���������������ʣ���������м����������ᣬFe2O3��Al2O3���ᷴӦ���ɵ������������������������費��Ӧ�����ˣ�����1Ϊ�������裻����Һ�м������۽������ӻ�ԭΪ�������ӣ�����pHֵʹ��������ȫ���������������������ˣ�����2Ϊ������������Һ2Ϊ��������������Ũ������ȴ�ᾧ�����ˣ��õ������������壬
A�������̷�����֪���ܽ�����ѡ���������ᣬXΪ���ۣ���A��ȷ��
B�������̷�����֪������1��һ������SiO2������pHֵʹ��������ȫ�����������������������2Ϊ������������B��ȷ��
C������Һ1�к��������Ӻ������ӣ��ӹ������������ƣ�������ת��Ϊƫ��������ӣ������������������ӽ���������������������������յõ�����������������������������C����
D�����������ױ������е���������������������ʧȥ�ᾧˮ�����Դ���Һ2�õ�FeSO4•7H2O��Ʒ�Ĺ����У������������ֹ�������ͷֽ⣬��D��ȷ��
��ѡC��
���� ���⿼���Ʊ�ʵ�鷽������������ۡ��������̵ķ���Ӧ�ã���Ŀ�Ѷ��еȣ�����ѧ�����������ʹ���������������ע����ճ������ʵķ��뷽����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | �����ķ�Ӧ�����û���Ӧ | B�� | ʵ��������Һ�Ǵ�ˮ����ֱ���ŷ� | ||
| C�� | ������һ����ͭ��п | D�� | ��Ӧǰ��Һ������Լ�����pH��С |
| A�� | CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=55.65kJ/mol | |
| B�� | CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-55.65kJ/mol | |
| C�� | CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-890.4kJ/mol | |
| D�� | CH4��g��+2O2�TCO2+2H2O��H=890.4kJ/mol |
| A�� | 29��13��8 | B�� | 13��29��8 | C�� | 22��14��1 | D�� | 26��57��15 |
| A�� | NH4+��SO42-��NO3- | B�� | Ba2+��SO42-��NO3- | C�� | Na+��H+��HCO3- | D�� | NH4+��OH-��Cl- |

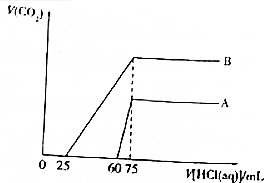 ȡ�����ʵ���Ũ�ȵ�NaOH��Һ����A��B��ÿ��50mL�������и�ͨ��һ������CO2��Ȼ���ȡ��Һ10mL���ֱ���ϡ��Ϊ100mL���ٷֱ���ϡ�ͺ����Һ����μ���0.1mol•L-1�����ᣬ��״���²���CO2��������������������֮��Ĺ�ϵ��ͼ��ʾ��
ȡ�����ʵ���Ũ�ȵ�NaOH��Һ����A��B��ÿ��50mL�������и�ͨ��һ������CO2��Ȼ���ȡ��Һ10mL���ֱ���ϡ��Ϊ100mL���ٷֱ���ϡ�ͺ����Һ����μ���0.1mol•L-1�����ᣬ��״���²���CO2��������������������֮��Ĺ�ϵ��ͼ��ʾ��