4.下列关于化学反应的描述中正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 甲烷的燃烧热△H=-890 kJ/mol,则甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890kJ/mol | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H=akJ/mol2C(s)+O2(g)=2CO(g)△H=bkJ/mol 则b<a | |
| D. | 已知:S(s)+O2(g)=SO2(g)△H=-Q1kJ/molS(g)+O2(g)=SO2(g)△H=-Q2kJ/mol 则Q1<Q2 |
2.如图表示反应2SO2 (g)+O2(g)?2SO3(g)△H<0的正反应速率随时间变化情况,试根据此曲线判断t1时刻改变的条件可能是( )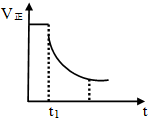

| A. | 降低温度 | B. | 减小压强 | C. | 减小SO3的浓度 | D. | 增大压强 |
1.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),达到平衡后,测得A的浓度为0.3mol?L-1,保持温度不变,将容器的容积缩小到原来的一半,测得A的浓度增大为0.5mol?L-1,下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡向逆反应方向移动 | ||
| C. | B的转化率降低 | D. | C的体积分数变大 |
20.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 在恒容的密闭容器中充入1molN2和3molH2,一定条件下发生反应,下列说法正确的是( )
| A. | 平衡后,缩小容器的容积,N2的浓度增大 | |
| B. | 平衡后,再向容器中充入1mol氦气,N2的转化率增大 | |
| C. | 平衡前,随着反应的进行,容器内气体密度逐渐增大 | |
| D. | 平衡时,该反应放出的热量为92.4kJ |
19.冶炼铁的化学方程式为Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-25KJ•mol-1.在恒容绝热的容器中进行上述反应,下列叙述中正确的是( )
0 173192 173200 173206 173210 173216 173218 173222 173228 173230 173236 173242 173246 173248 173252 173258 173260 173266 173270 173272 173276 173278 173282 173284 173286 173287 173288 173290 173291 173292 173294 173296 173300 173302 173306 173308 173312 173318 173320 173326 173330 173332 173336 173342 173348 173350 173356 173360 173362 173368 173372 173378 173386 203614
| A. | 该反应的平衡常数表达式为K=$\frac{{c}^{3}(CO)}{{c}^{3}(C{O}_{2})}$ | |
| B. | 升高温度,平衡常数增大 | |
| C. | 再向容器中通入CO,平衡常数减小 | |
| D. | 及时分离出生成物Fe,平衡向右移动,可提高原料利用率 |