题目内容
3.下列各种情况下一定能大量共存的离子组是( )A PH=1的溶液中Fe2+,Cl-,Na+,NO-3
B 由水电离的c(H+)=1×10-13 mol/L的溶液中:Na+,CO32-,Cl-,K+
C 无色溶液中:AlO-2,Na+,HCO3-,K+
D 遇甲基橙变红的溶液:NH4+,Cl-,Cu2+,SO42-.
| A. | A | B. | B | C. | C | D. | D |
分析 A.pH=1的溶液为酸性溶液,硝酸根离子在酸性条件下能够以后亚铁离子;
B.由水电离的c(H+)=1×10-13 mol/L的溶液为酸性或碱性溶液,碳酸根离子与氢离子反应;
C.偏铝酸根离子、铝离子发生双水解反应生成氢氧化铝沉淀;
D.遇甲基橙变红的溶液为酸性溶液,四种离子之间不反应,都不与氢离子反应.
解答 解:A.pH=1的溶液为酸性溶液中,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.由水电离的c(H+)=1×10-13 mol/L的溶液中存在大量氢离子或氢氧根离子,CO32-与氢离子反应,在溶液中不能大量共存,故B错误;
C.AlO-2、HCO3-之间反应双水解反应生成氢氧化铝沉淀,在溶液中不能大量共存,故C错误;
D.遇甲基橙变红的溶液为酸性溶液,溶液中存在大量氢离子,NH4+,Cl-,Cu2+,SO42-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.用如图装置进行的相应实验能达到实验目的是( )
| A. | 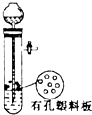 用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. |  用于分离水和苯的混合物 | |
| C. | 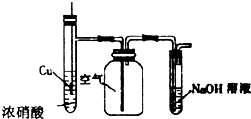 用于制备并收集NO2气体 | |
| D. |  用于除去碳酸氢钠固体中的少量碳酸钠 |
14.人体血液呈弱碱性,pH在7.35~7.45之间,超出范围会引起酸或碱中毒,下列有关血液说法不合理的是( )
| A. | 血液中溶解的CO2有平衡存在:CO2+H2O?H2CO3?H++HCO3- | |
| B. | 当pH<7.35时造成酸中毒,可静脉滴注NaHCO3溶液解毒 | |
| C. | 病人心肺复苏时大量使用NaHCO3,会造成血液的pH升高,引起碱中毒 | |
| D. | 取一定量pH=8.1的血液稀释到原体积的10倍,pH=7.1 |
11.下列反应符合图示的是( )


| A. | 酸碱中和反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 黑火药爆炸 | D. | 用焦炭制水煤气 |
18.下列描述中比值等于1:2的是( )
| A. | H2CO3溶液中c(CO32-):c(H+) | |
| B. | NaOH+HCl=NaCl+H2O与2NaOH+H2SO4=Na2SO4+2H2O 两反应的中和热之比 | |
| C. | Na2S溶液中c(S2-):c(Na+) | |
| D. | Na2O2中阴、阳离子个数之比 |
15.碳酸铰[(NH4)2CO3]在室温下就能自发地分解产生氨气,下列说法正确的是( )
| A. | 碳酸盐都不稳定,都能自发分解 | |
| B. | 碳酸铰分解是因为进行了加热的操作 | |
| C. | 碳酸铰分解是吸热反应,此反应不应该自发进行,必须借助外力才能进行 | |
| D. | 碳酸铰分解是因为生成了易挥发的气体,使体系的熵增大 |
12.完全中和24.6g二元酸H2A,消耗烧碱24g,则H2A的相对分子质量是( )
| A. | 42 | B. | 82 | C. | 162 | D. | 84 |
20.下列说法或表示法正确的是( )
| A. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8kJ•mol-1 | |
| B. | 已知C(石墨)→C(金刚石)△H=+119kJ•mol-1,则相同条件下等质量的石墨、金刚石分别完全燃烧,石墨放出的能量比金刚石的高 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3kJ | |
| D. | 已知25℃、101 kPa条件下:4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9 kJ/mol;4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.1kJ/mol,等质量的O2比O3能量低,由O2变O3为放热反应 |