12.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系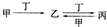 ,下列有关物质的推断正确的是( )
,下列有关物质的推断正确的是( )
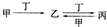 ,下列有关物质的推断正确的是( )
,下列有关物质的推断正确的是( )| A. | 若甲为Al,则丁可能是NaOH溶液 | B. | 若甲为氮气,则丁可能是O2 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为Ca(OH)2溶液,则丁可能是CO2 |
11.下列现象或事实能用同一原理解释的是( )
| A. | 氯化铵晶体和碘晶体加热都产生气体 | |
| B. | KMnO4、二氧化锰分别与浓盐酸混合(可加热),都产生黄绿色气体 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | SO2通入BaCl2溶液至饱和,再加入硝酸或苛性钠溶液,都能产生白色沉淀 |
10.下列画有横线的反应物在反应中不能完全消耗的是( )
| A. | 将含有少量CO2的CO通入足量Na2O2的试管中并不断用电火花引燃 | |
| B. | 向等物质的量的干冰和CaO的混合物中加几滴水 | |
| C. | 将1molCu置于含2molH2SO4的浓溶液中加热 | |
| D. | 在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量的CO2 |
9.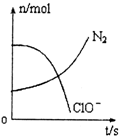 容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
0 173165 173173 173179 173183 173189 173191 173195 173201 173203 173209 173215 173219 173221 173225 173231 173233 173239 173243 173245 173249 173251 173255 173257 173259 173260 173261 173263 173264 173265 173267 173269 173273 173275 173279 173281 173285 173291 173293 173299 173303 173305 173309 173315 173321 173323 173329 173333 173335 173341 173345 173351 173359 203614
 容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 还原剂是含CN-的物质,氧化产物只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 氧化剂与还原剂的化学计量数之比为5:2 | |
| D. | 若生成2.24LN2,则转移电子必定为1mol |
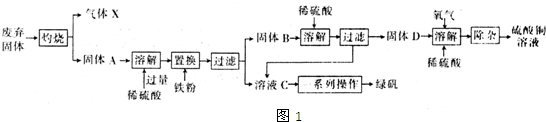
 对固体表面的化学过程的研究,有助于理解各种不同的过程.
对固体表面的化学过程的研究,有助于理解各种不同的过程. 三氯化铁广泛应用于污水处理、五金蚀刻及有机工业的催化剂、氧化剂和氯化剂等.
三氯化铁广泛应用于污水处理、五金蚀刻及有机工业的催化剂、氧化剂和氯化剂等.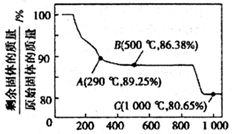 有报道称Co3O4能催化N2O分解,其中27Co在元素周期表中属于铁系元素,其单质及化合物的性质与铁有很多相似之处.
有报道称Co3O4能催化N2O分解,其中27Co在元素周期表中属于铁系元素,其单质及化合物的性质与铁有很多相似之处.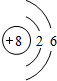 .
.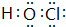 ,该化合物分子内存在共价键,E的钠盐属于离子化合物.
,该化合物分子内存在共价键,E的钠盐属于离子化合物.