14.对四组无色透明的强酸性溶液进行离子检验,四位同学各鉴定一组,他们实验报告的结论如下,其中可能正确的是( )
| A. | Na+、Ba2+、Cl-、NO${\;}_{3}^{-}$ | B. | Ca2+、NO${\;}_{3}^{-}$、HCO3-、Cl- | ||
| C. | K+、OH-、Cl-、SO42- | D. | MnO${\;}_{4}^{-}$、K+、S2-、Na+ |
13.晚自习的课间,同学们站在四楼上,可以看到市里的空中有移动的光柱,这就是气溶胶发生的丁达尔效应,下列说法不正确的是( )
| A. | 制备Fe(OH)3胶体的化学方程式是FeCl3+3H2O$\frac{\underline{\;煮沸\;}}{\;}$Fe(OH)3↓+3HCl | |
| B. | 胶体分散质粒子的直径介于1~100nm之间 | |
| C. | 利用丁达尔效应可鉴别胶体和溶液 | |
| D. | 胶体和溶液都是混合物,它们属于不同的分散系 |
12.以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
| A. | 三种气体CO、CO2、O3分别都含有1mol O,则三种气体的物质的量之比为3:2:1 | |
| B. | ng Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2L X气体分子的质量为16g,则X气体的摩尔质量是32 | |
| D. | 30g CO和22.4L CO2中含有的碳原子数一定相等 |
11.两份体积相同的某植物营养液,其配方分别如下:
下列对这两份营养液成分的分析中正确的是( )
| KCl | K2SO4 | ZnSO4 | |
| ① | 0.3mol•L-1 | 0.2mol•L-1 | 0.1mol•L-1 |
| ② | 0.1mol•L-1 | 0.3mol•L-1 | - |
| A. | K+的物质的量相同 | B. | Cl-的物质的量相同 | ||
| C. | 完全相同 | D. | SO${\;}_{4}^{2-}$的物质的量不同 |
10.下列关于仪器使用和操作的说法中不正确的是( )
| A. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| B. | 蒸馏时温度计水银球可以高于蒸馏烧瓶支管口 | |
| C. | 振摇分液漏斗时应关闭其玻璃塞和活塞 | |
| D. | 除去KNO3中少量NaCl:将混合物制成热的饱和溶液,冷却结晶,过滤 |
9.能用溶解、过滤、结晶的方法来分离的一组物质是( )
| A. | NaCl和淀粉 | B. | CuO和KCl | C. | BaSO4和CaCO3 | D. | KNO3和I2 |
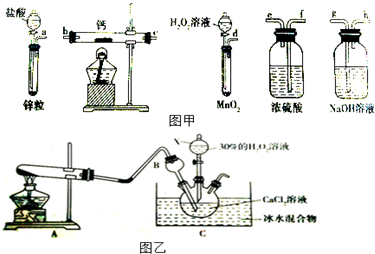
5.利用右图所示的装置进行下列实验,预测的现象和实际相符的是( )
0 173113 173121 173127 173131 173137 173139 173143 173149 173151 173157 173163 173167 173169 173173 173179 173181 173187 173191 173193 173197 173199 173203 173205 173207 173208 173209 173211 173212 173213 173215 173217 173221 173223 173227 173229 173233 173239 173241 173247 173251 173253 173257 173263 173269 173271 173277 173281 173283 173289 173293 173299 173307 203614
| 选项 | ①中的物质 | ②中的物质 | ③中的物质 | ③中的现象 |  |
| A | 浓氨水 | NaOH | AlCl3溶液 | 先产生白色沉淀,后沉淀溶解 | |
| B | 浓盐酸 | MnO2 | KI溶液 | 溶液变蓝色 | |
| C | 浓硫酸 | Na2SO3 | Ba(NO3)2溶液 | 无沉淀生成 | |
| D | 浓硝酸 | Cu | 含酚酞的NaOH溶液 | 溶液红色褪去 |
| A. | A | B. | B | C. | C | D. | D |
 .
.