题目内容
8.过氧化钙是一种温和的氧化剂,常温下为白色的固体,易溶于酸,难溶于水、乙醇等溶剂.某实验小组拟选用如图甲装置(部分固定装置略)制备过氧化钙.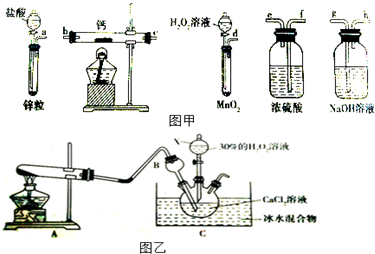
(1)请选择必要的装置,按气流方向连接顺序为dfebcf或dfecbf(填仪器接口的字母编号,装置可重复使用).
(2)根据完整的实验装置进行实验,实验步骤如下:
①检验装置的气密性后,装入药品;
②打开分液漏斗活塞,通入一段时间气体,加热药品;
③反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞(填操作);
④拆除装置,取出产物.
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO2.8H2O↓+2NH4+,在碱性环境下制取CaO2的装置如图乙所示:
①装置A中发生反应的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②NH3在Ca2+和H2O2的反应历程中所起的作用是中和过氧化氢和Ca2+反应析出的氢离子,促进反应进行(或使溶液呈碱性,减少CaO2•8H2O的溶解,或提高产品的产率).
③反应结束后,经过滤(填操作名称)、洗涤、低温烘干可获得CaO2.8H2O.检验CaO2.8H2O是否洗涤干净的操作为取最后的洗涤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液,若没有白色沉淀生成,则说明已经洗涤干净;反之则说明未洗涤干净.
④已知CaO2在350℃迅速分解生成CaO和O2.若所取产品质量是mg,加热至恒重时,剩余固体ng,则产品中CaO2的质量分数为$\frac{9(m-n)}{2m}$×100%(用字母表示).
(4)钙在空气中燃烧生成氮化钙(Ca3N2),同时可能生成过氧化钙.请利用下列试剂,设计试验检验钙的燃烧产物中是否含有过氧化钙取样品少许于试管中,加入酸化的FeCl2溶液溶解后,滴加KSCN溶液,若溶液变红色,则说明样品中含有过氧化钙;若溶液不变红色,则说明样品中不含有过氧化钙.(简要说明实验步骤、现象和结论)限选试剂:酸化的FeCl2溶液、NaOH溶液、KSCN溶液、稀硝酸.
分析 (1)一般制备纯净干燥的气体的实验装置的顺序为:制备装置→除杂装置→干燥装置等;
(2)实验结束时为防止空气进入装置,还要继续通氧气直到装置冷却;
(3)①根据装置图可知,A是用氯化铵与氢氧化钙加热制氨气,据此书写化学方程式;
②由于过氧化氢和Ca2+反应会产生氢离子,用氨气中和氢离子,可以促使反应正向进行;
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2.8H2O,通过检验洗涤滤液中是否有氯离子判断CaO2.8H2O是否洗涤干净;
④结合题意可知,氧气的质量为mg-ng,根据反应2CaO2$\frac{\underline{\;350℃\;}}{\;}$2CaO+O2↑,可求得过氧化钙的质量,进而确定质量分数;
(4)结合题中提供的试剂可知,通过利用过氧化钙能氧化亚铁离子的方法可判断燃烧产物中是否含有过氧化钙.
解答 解:(1)制备过氧化钙时,用双氧水制备氧气,钙属于极活泼的金属,极易与水反应生成氢氧化钙和氢气,而制备的氧气中会混有水蒸气,所以在与钙化合之前需要干燥,选用试剂是浓硫酸;同时为防止空气中水蒸气进入,最后还需要连接浓硫酸的洗气瓶,所以正确的顺序为:dfebcf或dfecbf;
故答案为:idfebcf或dfecbf;
(2)实验结束时为防止空气进入装置,还要继续通氧气直到装置冷却,所以实验结束时的操作为熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞,
故答案为:熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;
(3)①根据装置图可知,A是用氯化铵与氢氧化钙加热制氨气,反应的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②由于过氧化氢和Ca2+反应会产生氢离子,用氨气中和氢离子,可以促使反应正向进行,所以氨气的作用为中和过氧化氢和Ca2+反应析出的氢离子,促进反应进行(或使溶液呈碱性,减少CaO2•8H2O的溶解,或提高产品的产率),
故答案为:中和过氧化氢和Ca2+反应析出的氢离子,促进反应进行(或使溶液呈碱性,减少CaO2•8H2O的溶解,或提高产品的产率);
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2.8H2O,通过检验洗涤滤液中是否有氯离子判断CaO2.8H2O是否洗涤干净,操作为取最后的洗涤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液,若没有白色沉淀生成,则说明已经洗涤干净;反之则说明未洗涤干净,
故答案为:过滤;取最后的洗涤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液,若没有白色沉淀生成,则说明已经洗涤干净;反之则说明未洗涤干净;
④结合题意可知,氧气的质量为mg-ng,根据反应2CaO2$\frac{\underline{\;350℃\;}}{\;}$2CaO+O2↑,可求得过氧化钙的质量为4.5(m-n)g,所以产品中CaO2的质量分数为$\frac{4.5(m-n)g}{mg}$×100%=$\frac{9(m-n)}{2m}$×100%,
故答案为:$\frac{9(m-n)}{2m}$×100%;
(4)结合题中提供的试剂可知,通过利用过氧化钙能氧化亚铁离子的方法可判断燃烧产物中是否含有过氧化钙,设计试验为取样品少许于试管中,加入酸化的FeCl2溶液溶解后,滴加KSCN溶液,若溶液变红色,则说明样品中含有过氧化钙;若溶液不变红色,则说明样品中不含有过氧化钙,
故答案为:取样品少许于试管中,加入酸化的FeCl2溶液溶解后,滴加KSCN溶液,若溶液变红色,则说明样品中含有过氧化钙;若溶液不变红色,则说明样品中不含有过氧化钙.
点评 本题考查实验方案的设计、物质组成及含量测定计算,题目难度中等,充分考查学生的分析理解能力、知识迁移应用能力.

| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 2:3 |
| A. | 浓硝酸存放在带橡胶塞的棕色玻璃瓶中 | |
| B. | 四氯化碳萃取溴水中的溴时,水从分液漏斗下口流出 | |
| C. | 向饱和的NaCl溶液中通入足量的NH3后,再通入CO2,有晶体析出 | |
| D. | 某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+ |

| A. | 甲可能是钠 | B. | 乙可能是氢气 | ||
| C. | 丙可能是氧化铝 | D. | 丙可能是三氧化硫 |
| A. | 制备Fe(OH)3胶体的化学方程式是FeCl3+3H2O$\frac{\underline{\;煮沸\;}}{\;}$Fe(OH)3↓+3HCl | |
| B. | 胶体分散质粒子的直径介于1~100nm之间 | |
| C. | 利用丁达尔效应可鉴别胶体和溶液 | |
| D. | 胶体和溶液都是混合物,它们属于不同的分散系 |
| A. | 在合成氨的反应中,增大压强有利于氨的合成 | |
| B. | H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深 | |
| C. | 新制的氯水在光照下颜色变浅 | |
| D. | 氯气可以用排饱和食盐水的方法收集(Cl2+H2O═HCl+HClO) |