14.下列实验能达到预期目的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;②用NaOH溶液除去苯中的少量苯酚;③用饱和NaHCO3溶液除去CO2中的少量SO2;④用加热的方法提取NH4Cl固体中混有的少量碘;⑤用酒精萃取碘水中的碘.
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;②用NaOH溶液除去苯中的少量苯酚;③用饱和NaHCO3溶液除去CO2中的少量SO2;④用加热的方法提取NH4Cl固体中混有的少量碘;⑤用酒精萃取碘水中的碘.
| A. | ①⑤ | B. | ①②④⑤ | C. | ②③ | D. | ②③⑤ |
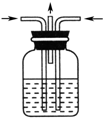
13.如图是实验室模拟煤的干馏的实验装置,下列叙述错误的是( )


| A. | 上图实验中发生了化学变化 | |
| B. | 液体Y是一种纯净物 | |
| C. | 气体Z易燃,可还原CuO | |
| D. | 水溶液X的pH>7,液体Y是黑色黏稠状的煤焦油 |
12.下列各组粒子中,所含化学键类型有差异的是( )
| A. | CCl4和CH2Cl2 | B. | H3O+和NH4+ | C. | CaO2和CaF2 | D. | Ba(OH)2和NaOH |
11.下列说法不正确的是( )
| A. | 发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染 | |
| B. | 物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化 | |
| C. | 氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 | |
| D. | 农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
10.下列变化过程中,没有发生化学变化的是( )
| A. | 用蒸馏法淡化海水 | B. | 从海带中提取碘 | ||
| C. | 石墨转化为金刚石 | D. | 氨气溶解在水中 |
9.如图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是( )


| A. | a的溶解度大于b的溶解度 | |
| B. | 在t℃时,a、b的饱和溶液中溶质的物质的量浓度相同 | |
| C. | 升高温度时,a、b溶解度均增大 | |
| D. | 在t℃时,将a、b的饱和溶液升温后,溶质的质量分数:a>b |
7.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
(1)推测反应III是吸热反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如下图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.
②若t2降低温度,t3达到平衡,请在图2中画出曲线X在t2-t4内 c(N2)的变化曲线.

0 173081 173089 173095 173099 173105 173107 173111 173117 173119 173125 173131 173135 173137 173141 173147 173149 173155 173159 173161 173165 173167 173171 173173 173175 173176 173177 173179 173180 173181 173183 173185 173189 173191 173195 173197 173201 173207 173209 173215 173219 173221 173225 173231 173237 173239 173245 173249 173251 173257 173261 173267 173275 203614
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如下图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.
②若t2降低温度,t3达到平衡,请在图2中画出曲线X在t2-t4内 c(N2)的变化曲线.

 ,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.
,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.