8.将4molA气体和2molB气体在2L的容器中混合,一定条件下发生如下反应:2A(g)+B(g)=2C(g)若经2s(秒)后测得C的浓度为0.6mol•L-1,下列说法正确的是( )
| A. | 2s时物质A的转化率为70% | |
| B. | 用物质B表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 用物质A表示的反应的平均速率为 0.3 mol•L-1•s-1 | |
| D. | 2s时物质B的浓度为0.6mol•L-1 |
5.硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),SO2的转化率随温度的变化如表所示:
(1)由表中数据判断?H<0(填“>”、“=”或“<”).
(2)能判断该反应已达到平衡状态的依据是ac (填序号).
a.混合气体中各组分的质量不变 b.c(SO2)=c(SO3) c.v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol/L,则:
①0~2min之间,O2的平均反应速率是0.08mol/(L•min).
②此时的温度是600℃.
③此温度下的平衡常数K=$\frac{400}{21}$(可用分数表示).
| 温度(℃) | 450 | 500 | 550 | 600 |
| SO2的转化率(%) | 97.5 | 95.8 | 90.50 | 80.0 |
(2)能判断该反应已达到平衡状态的依据是ac (填序号).
a.混合气体中各组分的质量不变 b.c(SO2)=c(SO3) c.v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol/L,则:
①0~2min之间,O2的平均反应速率是0.08mol/(L•min).
②此时的温度是600℃.
③此温度下的平衡常数K=$\frac{400}{21}$(可用分数表示).
3.在相同温度和体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料进行反应.平衡时有关数据如下
(已知相同条件下:2SO2+O2?2SO3△H=-196.6kJ/mol).
下列关系正确的是( )
(已知相同条件下:2SO2+O2?2SO3△H=-196.6kJ/mol).
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投入量 | 2molSO2+ 1mol O2 | 1molSO2+0.5molO2 | 2molSO3 | 2molSO2+2molO2 |
| 放出或吸收的热量(kJ) | a | b | c | d |
| 平衡时c(SO3)(mol/L) | e | f | g | h |
| A. | a>2b;e<2f | B. | a=c;e=g | C. | a>d;e>h | D. | c+98.3e=196.6 |
2. 水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数的表达式为K=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$,升高温度K将减小(填“增大”、“减小”或“不变”).
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡不移动(填“向左移”、“向右移”或“不移动”).
(3)上述反应在t0时刻达到平衡(如图),若在t1时刻缩小容器体积,请在图中继续画出t1时刻之后正、逆反应速率(ν正、ν逆)随时间的变化:
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
0 173014 173022 173028 173032 173038 173040 173044 173050 173052 173058 173064 173068 173070 173074 173080 173082 173088 173092 173094 173098 173100 173104 173106 173108 173109 173110 173112 173113 173114 173116 173118 173122 173124 173128 173130 173134 173140 173142 173148 173152 173154 173158 173164 173170 173172 173178 173182 173184 173190 173194 173200 173208 203614
 水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1(1)该反应的平衡常数的表达式为K=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$,升高温度K将减小(填“增大”、“减小”或“不变”).
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡不移动(填“向左移”、“向右移”或“不移动”).
(3)上述反应在t0时刻达到平衡(如图),若在t1时刻缩小容器体积,请在图中继续画出t1时刻之后正、逆反应速率(ν正、ν逆)随时间的变化:
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.6 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
 向某一容积为5L的密闭容器中,加入 0.2mol CO和0.2mol H2O,在800℃和催化剂的条件下,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化关系如图所示:
向某一容积为5L的密闭容器中,加入 0.2mol CO和0.2mol H2O,在800℃和催化剂的条件下,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化关系如图所示: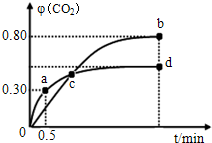 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为: 已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:
已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答: 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示,2min后反应达到平衡.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示,2min后反应达到平衡.由图中数据分析: