20.下列反应的离子方程式书写正确的是( )
| A. | 在澄清石灰水中加入少量小苏打:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO | |
| D. | 将标准状况下112mL氯气通入10mL浓度为1mol•L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=3Fe3++6Cl-+2Br2 |
15.下列说法不正确的是( )
| A. | 等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 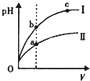 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.Ⅱ为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.Ⅱ为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b | |
| D. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 |
14.改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡时CH3OH的浓度c(Ⅰ)<c(Ⅱ) (填“>”、“<”或“=”).
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol/(L.min).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
0 173007 173015 173021 173025 173031 173033 173037 173043 173045 173051 173057 173061 173063 173067 173073 173075 173081 173085 173087 173091 173093 173097 173099 173101 173102 173103 173105 173106 173107 173109 173111 173115 173117 173121 173123 173127 173133 173135 173141 173145 173147 173151 173157 173163 173165 173171 173175 173177 173183 173187 173193 173201 203614
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol/(L.min).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
 食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O,样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.(已知K4[Fe(CN)6]•3H2O相对分子质量为422;K4[Fe(CN)6]相对分子质量为368)
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O.42.2g K4[Fe(CN)6]•3H2O,样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.(已知K4[Fe(CN)6]•3H2O相对分子质量为422;K4[Fe(CN)6]相对分子质量为368) 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)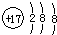 .
.