题目内容
15.下列说法不正确的是( )| A. | 等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 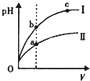 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.Ⅱ为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.Ⅱ为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b | |
| D. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 |
分析 A.等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,二者恰好反应生成硫酸钠、硫酸铵和水,根据原子守恒得c(Na+)=c(SO42-),铵根离子水解导致c(SO42-)>c(NH4+)且溶液呈酸性,铵根离子水解程度较小,据此判断离子浓度大小;
B.25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,盐酸溶液体积增大一倍,则氯离子浓度降为原来的一半,且反应完全时溶液中c(NH4+)=c(C1-),则混合溶液中c(NH4+)=c(C1-)=0.005mol/L,根据电荷守恒及溶液呈中性得c(H+)=c(OH-)=10-7 mol/L,溶液中c(NH3•H2O)-c(NH4+)=0.5amol/L-0.005mol/L,据此计算NH3•H2O的电离常数Kb;
C.相同温度下,pH相等的醋酸和盐酸中,二者c(H+)相等,加水稀释过程中,醋酸电离出H+导致醋酸溶液中c(H+)大于盐酸,所以稀释过程中醋酸pH小于盐酸,酸抑制水电离,酸中氢离子浓度越大其抑制水电离程度越大;
D.酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸.
解答 解:A.等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,二者恰好反应生成硫酸钠、硫酸铵和水,根据原子守恒得c(Na+)=c(SO42-),铵根离子水解导致c(SO42-)>c(NH4+)且溶液呈酸性,所以c(H+)>c(OH-),铵根离子水解程度较小,所以离子浓度大小顺序是c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故A正确;
B.25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,盐酸溶液体积增大一倍,则氯离子浓度降为原来的一半,且反应完全时溶液中c(NH4+)=c(C1-),则混合溶液中c(NH4+)=c(C1-)=0.005mol/L,根据电荷守恒及溶液呈中性得c(H+)=c(OH-)=10-7 mol/L,溶液中c(NH3•H2O)-c(NH4+)=0.5amol/L-0.005mol/L,则NH3•H2O的电离常数Kb=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{0.005×1{0}^{-7}}{0.5a-0.005}$=$\frac{1{0}^{-9}}{a-0.01}$,故B正确;
C.相同温度下,pH相等的醋酸和盐酸中,二者c(H+)相等,加水稀释过程中,醋酸电离出H+导致醋酸溶液中c(H+)大于盐酸,所以稀释过程中醋酸pH小于盐酸,酸抑制水电离,酸中氢离子浓度越大其抑制水电离程度越大,所以水电离程度:a<b,故C正确;
D.酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性强弱顺序是H2CO3>HCN>HCO3-,则碳酸钠和HCN反应生成碳酸氢钠和NaCN,没有气体生成,故D错误;
故选D.
点评 本题考查离子浓度大小比较、弱电解质的电离、强酸制取弱酸等知识点,明确溶液中溶质及其性质是解本题关键,侧重考查学生分析计算能力,难点是B,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 蒸馏水 氨水 氧化铝 二氧化硫 | |
| B. | 盐酸 空气 硫酸 干冰 | |
| C. | 胆矾 盐酸 铁 碳酸钙 | |
| D. | 生石灰 硫酸 氯化铜 碳酸钠 |
| A. | CH3CH3+Cl2 $\stackrel{光照}{→}$ CH2=CH2+2HCl | |
| B. | CH2=CH2+Br2→CH3CHBr2 | |
| C. | CH3CH2OH+O2$→_{△}^{Cu}$CH3CHO+H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O |
| A. | X的化学式为Na2SO4 | B. | SO2污染空气 | ||
| C. | Na2S2O3中S的化合价为+2 | D. | Na2S2O4要在干燥阴凉处密闭保存 |
| A. | 在澄清石灰水中加入少量小苏打:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO | |
| D. | 将标准状况下112mL氯气通入10mL浓度为1mol•L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=3Fe3++6Cl-+2Br2 |
| A. | 一定等于0.3mol | B. | 一定小于0.3mol | C. | 一定大于0.3mol | D. | 可能等于0.3mol |
 ;
;