12.丙烷曾多次作为奥运会火炬燃料,它也是液化石油气的主要成分.已知:
①2C2H8(g)+7O2(g)=6CO(g)+8H2O(l)△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(1)反应C2H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=-2219.9kJ/mol.
(2)C2H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
CO(g)+H2O(g)?CO2(g)+H2(g)
①下列事实能说明该反应以达到平衡的是bd.
a.体系中的压强不发生反应
b.v正(H2)=v逆(CO)
c.混合气体的平均相对分子质量不再发生变化
d.CO2的浓度不再发生变化
②T℃时,在一定体积的容器中通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度变化如下表:
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的.则第4~5min之间改变的条件是可能是增大氢气的浓度,第5~6min之间改变的条件是增大水蒸气的浓度.已知420℃时,该化学反应的平衡常数为9,如果反应开始时,CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为75%.又知397℃时该反应的平衡常数为12,请判断该反应的△H<0(填“>”“=”或“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的参杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-移向负极(填“正”或“负”);电池的负极反应式为C3H8+10O2--20e-=3CO2+4H2O.
(4)用上述燃料电池,用惰性电池电解足量Al(NO3)3和NaCl的混合溶液.电解过程中,在阴极附近能观察到的现象是有气体生成,生成白色沉淀,后白色沉淀又溶解.
①2C2H8(g)+7O2(g)=6CO(g)+8H2O(l)△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(1)反应C2H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=-2219.9kJ/mol.
(2)C2H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
CO(g)+H2O(g)?CO2(g)+H2(g)
①下列事实能说明该反应以达到平衡的是bd.
a.体系中的压强不发生反应
b.v正(H2)=v逆(CO)
c.混合气体的平均相对分子质量不再发生变化
d.CO2的浓度不再发生变化
②T℃时,在一定体积的容器中通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度变化如下表:
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的参杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-移向负极(填“正”或“负”);电池的负极反应式为C3H8+10O2--20e-=3CO2+4H2O.
(4)用上述燃料电池,用惰性电池电解足量Al(NO3)3和NaCl的混合溶液.电解过程中,在阴极附近能观察到的现象是有气体生成,生成白色沉淀,后白色沉淀又溶解.
11.请按要求完成下列各小题:
(1)用CO2来生产燃料甲醇的反应原理为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
计算上述反应的焓变△H=(2d+3b-c-3a-3e)kJ/mol(用相应字母表示).写出上述反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;若只加压,则平衡常数K不变(填“增大”“减小”或“不变”).
(2)在溶液中,NaH2PO4和Na3PO4等物质的量混合恰好完全反应,该反应的离子方程式为H2PO4-+PO43-=2HPO42-,
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=10.在此温度下,将0.01mol•L-1的H2SO4溶液VaL与P
H=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va:Vb=15:2.
(4)在25℃时,将cmol•L-1的醋酸溶液与bmol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka=$\frac{b×1{0}^{-7}}{c-b}$.
(5)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-2(数据顺序以打乱),已知三种酸和它们的盐之间能发生以下反应:HA+HB-(少量)=A-+H2B,H2B(少量)+C-=HB-+HC.则三种酸对应的电离平衡常数分别为(请用序号填空)
(1)用CO2来生产燃料甲醇的反应原理为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kj•mol-1 | a | b | c | d | e |
(2)在溶液中,NaH2PO4和Na3PO4等物质的量混合恰好完全反应,该反应的离子方程式为H2PO4-+PO43-=2HPO42-,
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=10.在此温度下,将0.01mol•L-1的H2SO4溶液VaL与P
H=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va:Vb=15:2.
(4)在25℃时,将cmol•L-1的醋酸溶液与bmol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka=$\frac{b×1{0}^{-7}}{c-b}$.
(5)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-2(数据顺序以打乱),已知三种酸和它们的盐之间能发生以下反应:HA+HB-(少量)=A-+H2B,H2B(少量)+C-=HB-+HC.则三种酸对应的电离平衡常数分别为(请用序号填空)
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
5.现有CaCO3、BaCO3的混合矿石粉末,为了制得纯净的CaCO3和纯净BaCO3,从有关资料中查得有关溶解度数据和工艺流程如下:

(1)将矿粉变为CaO、BaO的混合物通常采用焦炭作为能源,从经济效益的角度考虑,除焦炭价格便宜意外,还有一个重要原因是利用焦炭燃烧产生的高温使矿石分解,有关反应为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑,上述反应生成的二氧化碳经净化后,可用作制取纯净CaCO3、BaCO3的原料.
(2)试剂a是水(填名称),操作Ⅰ的具体操作过程是将混合液升温至80℃,析出Ca(OH)2,过滤得到Ca(OH)2固体和Ba(OH)2溶液.
(3)试剂b与试剂c是否是同一物质?否(填“是”或“否”),写出加入试剂c后发生反应的离子方程式:CO2+Ba2++2OH-=BaCO3↓+H2O.
| 0℃ | 50℃ | 80℃ | |
| Ca(OH)2 | 0.173g | 0.13g | 0.094g |
| Ba(OH)2•8H2O | 1.64g | 13.2g | 101.4g |

(1)将矿粉变为CaO、BaO的混合物通常采用焦炭作为能源,从经济效益的角度考虑,除焦炭价格便宜意外,还有一个重要原因是利用焦炭燃烧产生的高温使矿石分解,有关反应为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑,上述反应生成的二氧化碳经净化后,可用作制取纯净CaCO3、BaCO3的原料.
(2)试剂a是水(填名称),操作Ⅰ的具体操作过程是将混合液升温至80℃,析出Ca(OH)2,过滤得到Ca(OH)2固体和Ba(OH)2溶液.
(3)试剂b与试剂c是否是同一物质?否(填“是”或“否”),写出加入试剂c后发生反应的离子方程式:CO2+Ba2++2OH-=BaCO3↓+H2O.
4.下列实验描述,不正确的是( )
0 172966 172974 172980 172984 172990 172992 172996 173002 173004 173010 173016 173020 173022 173026 173032 173034 173040 173044 173046 173050 173052 173056 173058 173060 173061 173062 173064 173065 173066 173068 173070 173074 173076 173080 173082 173086 173092 173094 173100 173104 173106 173110 173116 173122 173124 173130 173134 173136 173142 173146 173152 173160 203614
| A. | 同样是在氯气中点燃,铁少量生成的是氯化铁,过量时则生成氯化亚铁 | |
| B. | 同样是试纸检测,检验气体需要润湿,检验溶液时则一般不能润湿 | |
| C. | 同样是配制溶液,一定质量分数的溶液配制使用烧杯,而一定物质的量浓度的溶液配制则还需要容量瓶 | |
| D. | 同样是浓溶液(设其质量分数为ω )与水等体积混合,所得硫酸的浓度大于 0.5ω,氨水的则小于 0.5ω |
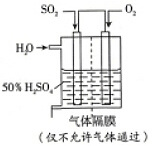 SO2的催化氧化是工业上生产硫酸的关键步骤.
SO2的催化氧化是工业上生产硫酸的关键步骤.
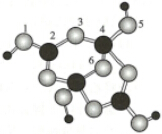
 ;反应过程中只会释放出一种小分子CH4.
;反应过程中只会释放出一种小分子CH4.
 、
、 .
.
 ,电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d46s2.
,电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d46s2.