18.下列说法不正确的是( )
| A. | 碱性氧化物一定是金属氧化物 | |
| B. | Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同 | |
| C. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| D. | 共价化合物固态时不导电,熔融态时导电 |
14.25℃时体积为1L浓度为0.15mol•L-1的NaOH溶液充分吸收2.24LCO2(标准状况),温度恢复到25℃.下列有关上述反应后溶液的说法及关系正确的是( )
| A. | 反应过程中CO2过量,溶液的pH<7 | B. | 水的离子积常数Kw<10-14 | ||
| C. | 2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)] | D. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
13.下列各表述与示意图一致的是( )
| A. | 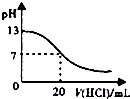 如图表示室温时,用0.1 mol.L-1 盐酸滴定0.1 mol•L-1NaOH溶液过程中的pH变化 | |
| B. | 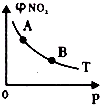 T℃时,反应2NO2(g)  N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 | |
| C. | 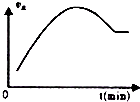 如图表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g)?2C(g)达到平衡,正反应速率随时间变化的示意图.由图可得出的结论是:反应物的总能量低于生成物的总量 | |
| D. | 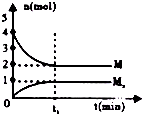 如图在恒温恒容的密闭容器中,气体M存在如下关系xM(g)?Mx(g),t1时刻,保持温度不变,再充入1mol M,重新达到平衡时$\frac{c(Mx)}{c(M)}$将增大 |
12.已知298K下反应2Al2O3(s)+3C(s)═4Al(s)+3CO2(g)△H=+2 171kJ/mol,△S=+635.5J/(mol•K),则下列说法正确的是( )
| A. | 由题给△H值可知,该反应是一个放热反应 | |
| B. | △S>0表明该反应是一个熵增加的反应 | |
| C. | 该反应在室温下可能自发 | |
| D. | 不能确定该反应能否自发进行 |
11.能源短缺是全球面临的问题,用CO2来生产燃料甲醇的反应原理为CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 已知某些化学键的键能数据如表所示:
则该反应的焓变△H为( )
0 172942 172950 172956 172960 172966 172968 172972 172978 172980 172986 172992 172996 172998 173002 173008 173010 173016 173020 173022 173026 173028 173032 173034 173036 173037 173038 173040 173041 173042 173044 173046 173050 173052 173056 173058 173062 173068 173070 173076 173080 173082 173086 173092 173098 173100 173106 173110 173112 173118 173122 173128 173136 203614
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 413.4 | 436.0 | 351.0 | 745.0 | 462.8 |
| A. | -46.2 kJ•mol-1 | B. | +46.2 kJ•mol-1 | C. | -181.6 kJ•mol-1 | D. | +181.6 kJ•mol-1 |
 研究硫及其化合物性质有重要意义.
研究硫及其化合物性质有重要意义.
