题目内容
14.25℃时体积为1L浓度为0.15mol•L-1的NaOH溶液充分吸收2.24LCO2(标准状况),温度恢复到25℃.下列有关上述反应后溶液的说法及关系正确的是( )| A. | 反应过程中CO2过量,溶液的pH<7 | B. | 水的离子积常数Kw<10-14 | ||
| C. | 2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)] | D. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
分析 n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,CO32-水解程度大于HCO3-,以此解答该题.
解答 解:A、n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,溶液显示碱性,pH大于7,故A错误;
B、25℃水的离子积常数Kw=10-14,故B错误;
C、n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,溶液中主要存在Na+、CO32-、HCO3-、H2CO3,根据物料守恒,应有2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)],故C正确;
D、在等物质的量浓度的碳酸钠和碳酸氢钠的混合液中,碳酸根离子的水解程度大于碳酸氢根离子,所以c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故D错误.
故选C.
点评 本题考查混合物反应的计算和判断,解答本题时,可根据反应物的物质的量关系快速写出反应的化学方程式,是计算的一种很好的方法,同学们可借鉴.

练习册系列答案
相关题目
5.下列现象与胶体性质无关的是( )
| A. | 江河入海口三角洲的形成 | B. | 向豆浆中加入石膏可制得豆腐 | ||
| C. | FeCl3溶液呈现黄色 | D. | 不同品牌的墨水不能混用 |
2.化学实验设计或实际操作或储存时,能体现“经济、高效、环保、安全”方案是( )
| A. | Na 着火可以使用泡沫灭火器 | |
| B. | 绿色化学是指有毒气体尾气要经过无毒处理后在排放 | |
| C. | 实验室用浓硫酸溶解铜制备硫酸铜 | |
| D. | 实验室可以适当温度下,使铜片在持续通入空气的稀硫酸中溶解的方法制备硫酸铜 |
3.下列各组物质中,被氧化与被还原的物质的物质的量之比为1:2的是( )
| A. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| B. | SO2+2H2S═3S+2H2O | |
| C. | 3NO2+H2O═2HNO3+NO | |
| D. | 3S+6KOH═2K2S+K2SO3+3H2O |


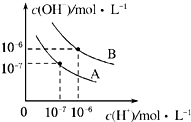 已知水在25℃和95℃时,其电离平衡曲线如图所示.
已知水在25℃和95℃时,其电离平衡曲线如图所示.