13.丙酮和苯酚都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如图:
相关化合物的物理常数
回答下列问题:
(1)反应①和②分别在装置A和C中进行(填装置符号).
(2)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(3)在反应器A中通入的X是氧气或空气.
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(5)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.

相关化合物的物理常数
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 苯酚 | 94 | 1.0722 | 182 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 异丙苯 | 120 | 0.8640 | 153 |
(1)反应①和②分别在装置A和C中进行(填装置符号).
(2)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(3)在反应器A中通入的X是氧气或空气.
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(5)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.
12.半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的 Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
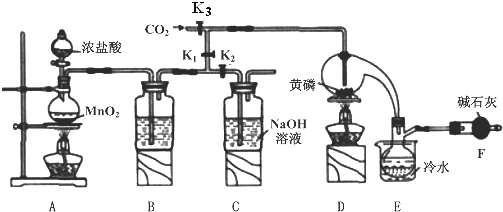
已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓硫酸,F中碱石灰的作用有两种,分别是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应.
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等,加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.

已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓硫酸,F中碱石灰的作用有两种,分别是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应.
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等,加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
9.在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为0.02mol•L-1.在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍.下列说法不正确的是( )
0 172608 172616 172622 172626 172632 172634 172638 172644 172646 172652 172658 172662 172664 172668 172674 172676 172682 172686 172688 172692 172694 172698 172700 172702 172703 172704 172706 172707 172708 172710 172712 172716 172718 172722 172724 172728 172734 172736 172742 172746 172748 172752 172758 172764 172766 172772 172776 172778 172784 172788 172794 172802 203614
| A. | 前2s,N2O4的平均反应速率为0.005mol•L-1•s-1 | |
| B. | 平衡时,N2O4的转化率为50% | |
| C. | 平衡时,体系内NO2为0.04mol•L-1 | |
| D. | 在2s时,体系内压强为反应前的1.1倍 |

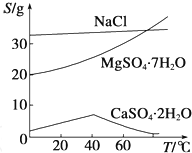

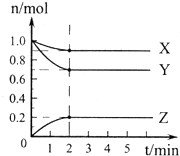 (1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y
(1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y 2Z.
2Z.
 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: