4.下列说法正确的是( )
| A. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| B. | 酸性氧化物都只能与碱反应不能与任何酸发生反应 | |
| C. | 工业上用焦炭和石英制取粗硅的反应方程式为SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| D. | 不能用SiO2与水反应的方法来制取硅酸,不能用瓷坩埚来加热烧碱或纯碱使其熔化 |
3.下列离子反应方程式表示正确的是( )
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
2.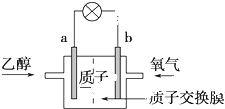 一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )
 一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )| A. | b极为电池的负极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 当1 mol乙醇被氧化转移12NA个电子 | |
| D. | 电池负极的电极反应为4H++O2+4e-═2H2O |
1.1,2-二甲基环己烷(  )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )
 )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
20.用NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4LCHCl3中含有的氯原子的数目为3NA | |
| B. | 25℃、101kPa下,16gO3和O2混合气体中含有的氧原子数为NA | |
| C. | 等质量的N2和CO所含分子数相同且均为NA | |
| D. | 一定温度下,1L 1mol•L-1的CH3COONa溶液含NA个CH3COO- |
19.元素周期表和元素周期律可以指导人们进行推测和判断.下列说法不合理的是( )
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | ⅥA族元素的原子,其半径越大,气态氢化物越稳定 | |
| C. | 硅、锗都位于金属与非金属的交界处,都可以作半导体材料 | |
| D. | Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2 |
18.下列晶胞中,属于面心立方最密堆积的是( )
| A. |  | B. |  | C. |  | D. |  |
17.用下列物质冶炼相应金属时采用电解法的是( )
| A. | Fe2O3 | B. | Ag2O | C. | Cu2S | D. | Al2O3 |
16.化学与环境密切相关,下列有关说法正确的是( )
| A. | CO2属于大气污染物 | |
| B. | 酸雨是pH小于7的雨水 | |
| C. | 大气中CO2含量的增加会导致温室效应加剧 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
15.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
0 172450 172458 172464 172468 172474 172476 172480 172486 172488 172494 172500 172504 172506 172510 172516 172518 172524 172528 172530 172534 172536 172540 172542 172544 172545 172546 172548 172549 172550 172552 172554 172558 172560 172564 172566 172570 172576 172578 172584 172588 172590 172594 172600 172606 172608 172614 172618 172620 172626 172630 172636 172644 203614

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)