13.80g密度为ρg.cm-3的CaCl2溶液里含2gCa2+,从中再取出一半的溶液中Cl-的浓度是( )
| A. | $\frac{ρ}{800}$mol•L-1 | B. | 1.25ρmol•L-1 | C. | $\frac{ρ}{1600}$mol•L-1 | D. | 0.63mol•L-1 |
12.由硫酸钠、硫酸、硫酸铝组成的混合溶液的pH=1,并且c(SO${\;}_{4}^{2-}$)=0.8mol•L-1,c=(Na+)=0.3mol•L-1,则c(Al3+)为( )
| A. | 0.4mol•L-1 | B. | 0.43mol•L-1 | C. | 0.8mol•L-1 | D. | 1.2mol•L-1 |
11.用NA表示阿德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6LO2与5.6LNO混合后的分子总数为0.5NA | |
| B. | 标准状况下,22.4升苯分子中含有6NA个C-Cσ键和6NAC-Hσ键 | |
| C. | 7.8克过氧化钠中含0.2NA阳离子和0.1NA阴离子 | |
| D. | 在500ml0.1mol•L-1NaAlO2溶液中AlO${\;}_{2}^{-}$数为5×10-2NA |
9.下列说法不正确的是( )
| A. | 过滤时,玻璃棒与三层滤纸的一边接触,漏斗下端紧贴烧杯内壁 | |
| B. | 分液时,下层液体应从分液漏斗下口放出,上层液体从上口倒出 | |
| C. | 蒸馏时,在蒸馏烧瓶中盛约 $\frac{1}{3}$体积的液体,并放入几粒沸石,将温度计水银球插入液体中,冷水从冷凝管下口进,上口出,收集时,应弃去开始馏出的部分液体 | |
| D. | 加热蒸发氯化钠溶液时,加热到有大量晶体析出时即停止加热,不能加热到全部蒸干 |
8.下列反应的离子方程式书写正确的是( )
| A. | Fe0溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | 明矾溶液中滴加过量氨水:Al3++3NH3.H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| C. | 漂白粉溶液中通入S02:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ | |
| D. | 小苏打溶液中加足量澄清石灰水:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+2H2O+CO${\;}_{3}^{2-}$ |
7. 某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示.下列推断不合理的是( )
某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示.下列推断不合理的是( )
 某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示.下列推断不合理的是( )
某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示.下列推断不合理的是( )| A. | 烧杯中H2O2溶液作用是将Fe2+氧化为Fe3+ | |
| B. | a中的氧化铁与盐酸反应生成氯化铁 | |
| C. | b中收集到的气体是氢气 | |
| D. | 烧杯中溶液蒸发结晶得到氯化铁晶体 |
6.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 常温常压下,16gS03中含有的分子数为0.2NA | |
| B. | 常温下,30gSiO2晶体中含有Si--O键的数目为NA | |
| C. | 标准状况下,2.2 LCl2与足量水反应转移的电子数为0.1NA | |
| D. | 标准状况下,92.4 LNO与11.2LO2混合后所含分子数为NA |
5.已知X、Y、Z、W是中学化学中常见的4种物质,其转化关系符合如图.下列说法错误的是( )
0 172441 172449 172455 172459 172465 172467 172471 172477 172479 172485 172491 172495 172497 172501 172507 172509 172515 172519 172521 172525 172527 172531 172533 172535 172536 172537 172539 172540 172541 172543 172545 172549 172551 172555 172557 172561 172567 172569 172575 172579 172581 172585 172591 172597 172599 172605 172609 172611 172617 172621 172627 172635 203614

| A. | 若Y+W→Z是非氧化还原反应,则W可能是碱溶液 | |
| B. | 若Y+W→Z是非氧化还原反应,则W可能是酸溶液 | |
| C. | 若Y+W→Z是氧化还原反应.则X可能是金属铝 | |
| D. | 若Y+W→Z是氧化还原反应,则X可能是非金属碳 |
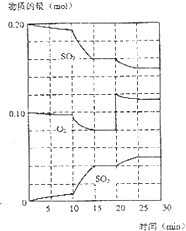 熵可以表示体系的混乱度,请你判断以下过程是熵增加过程还是熵减小过程:(填“熵增”或“熵减”)
熵可以表示体系的混乱度,请你判断以下过程是熵增加过程还是熵减小过程:(填“熵增”或“熵减”)