9.下列说法正确的是( )
| A. | 原子最外层电子数大于4的元素可能是金属元素 | |
| B. | 含有共价键的物质一定是共价化合物 | |
| C. | 离子化合物中只可能含有离子键而不可能含有共价键 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
8.下列叙述中,正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
5.在原子结构示意图中,M层最多能容纳电子数目为( )
| A. | 2 | B. | 8 | C. | 18 | D. | 32 |
3.某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是铜丝导热性良好,会对中和热的计算造成影响.
(3)他们记录的实验数据如下:
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18J•℃-1•g-1,各物质的密度均为1g•cm-3.根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式(△H值精确到小数点后2位):HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.85kJ•mol-1
(4)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是铜丝导热性良好,会对中和热的计算造成影响.
(3)他们记录的实验数据如下:
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20℃ | 23.5℃ | |
(4)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响.
2.以下有关元素性质的说法不正确的是( )
0 172295 172303 172309 172313 172319 172321 172325 172331 172333 172339 172345 172349 172351 172355 172361 172363 172369 172373 172375 172379 172381 172385 172387 172389 172390 172391 172393 172394 172395 172397 172399 172403 172405 172409 172411 172415 172421 172423 172429 172433 172435 172439 172445 172451 172453 172459 172463 172465 172471 172475 172481 172489 203614
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p1${\;}^{2{2}^{3}}$③1s22s22p2④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p 2 ③3s23p3 ④33s23p 4第一电离能最大是③ | |
| C. | ①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ |
 按要求完成下列问题.
按要求完成下列问题. 生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一. 用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:?
用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:?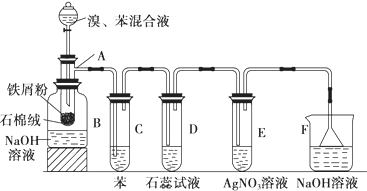
 ,该有机反应的类型为取代反应.
,该有机反应的类型为取代反应.