7.下列除去杂质方法正确的是( )
| A. | 除去CO2中混有的CO:用浓NaOH溶液洗气 | |
| B. | 除去BaCO3固体中混有的BaSO4:加过量稀盐酸后,过滤、洗涤 | |
| C. | 除去KNO3溶液中混有的NaCl:蒸发结晶 | |
| D. | 除去Cu粉中混有的CuO:加适量稀硫酸后,过滤、洗涤 |
6.下列有关实验操作与结论都正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某钠盐中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 说明该盐一定是碳酸盐 |
| B | 向某无色溶液中滴加BaCl2溶液,再滴加过量的稀HNO3,产生白色沉淀 | 该无色溶液中一定有SO42- |
| C | 向某无色溶液中滴加NaOH溶液,加热后,产生是湿润的红色石蕊试纸变蓝的气体 | 说明溶液液中含有NH4+ |
| D | 某无色气体通过灼热的CuO,CuO变为红色 | 该气体一定为氢气 |
| A. | A | B. | B | C. | C | D. | D |
5.工业上合成氨的反应:N2(g)+3H2(g)═2NH3(g)△H=-92.60kJ•mol-1.
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g),下列说法能说明上述反应向正反应方向进行的是②④(填序号).
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H键的同时生成2n mol H-H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2h时放出的热量为27.66 kJ.
②此温度下该反应的化学平衡常数K=0.15(保留两位小数).
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”或“不移动”).
④有甲、乙两个完全相同的容器,向甲容器中加入1mol N2 (g)和6mol H2 (g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2mol NH3 (g)和3mol H2 (g),达到平衡时的热效应(放热或吸热)为4Q.则甲容器中H2的转化率为10%.
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g),下列说法能说明上述反应向正反应方向进行的是②④(填序号).
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H键的同时生成2n mol H-H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
①反应进行到2h时放出的热量为27.66 kJ.
②此温度下该反应的化学平衡常数K=0.15(保留两位小数).
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”或“不移动”).
④有甲、乙两个完全相同的容器,向甲容器中加入1mol N2 (g)和6mol H2 (g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2mol NH3 (g)和3mol H2 (g),达到平衡时的热效应(放热或吸热)为4Q.则甲容器中H2的转化率为10%.
19.下列事实与胶体性质无关的是( )
| A. | 在豆浆里加入盐卤做豆腐 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路 | |
| D. | FeCl3溶液中滴入NaOH溶液出现红褐色沉淀 |
18.茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在(已知CaC2O4为白色沉淀物质).首先取200g茶叶样品焙烧得灰粉后进行如下操作:
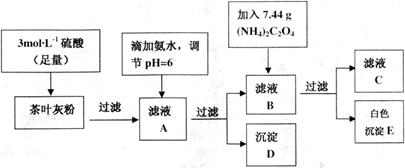
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
实验前要先将茶叶样品高温灼烧成灰粉,需用到的仪器有①③④⑤.
①酒精灯 ②蒸发皿 ③坩埚 ④泥三角 ⑤三脚架 ⑥铁架台
(2)写出从滤液A→沉淀D的离子反应方程式的是Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是向最后一次洗涤少许与试管中,滴加碳酸钠溶液,若无沉淀产生,说明洗净.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:
5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H-═10CO2↑+22++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000
mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
①此步操作过程中一定需要用到下列哪些仪器(填写序号)B、C、D;

②达到滴定终点时,溶液的颜色变化是无色变为紫色或高锰酸钾溶液不褪色;
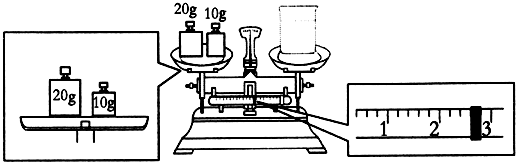
③滴定到终点,静置后,如图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高 (填“偏高”、“偏低”、“无影响”).
(5)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是KSCN溶液,溶液呈红色.
(6)原茶叶中钙元素的质量分数为0.2%.
0 172276 172284 172290 172294 172300 172302 172306 172312 172314 172320 172326 172330 172332 172336 172342 172344 172350 172354 172356 172360 172362 172366 172368 172370 172371 172372 172374 172375 172376 172378 172380 172384 172386 172390 172392 172396 172402 172404 172410 172414 172416 172420 172426 172432 172434 172440 172444 172446 172452 172456 172462 172470 203614

请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |
①酒精灯 ②蒸发皿 ③坩埚 ④泥三角 ⑤三脚架 ⑥铁架台
(2)写出从滤液A→沉淀D的离子反应方程式的是Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是向最后一次洗涤少许与试管中,滴加碳酸钠溶液,若无沉淀产生,说明洗净.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:
5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H-═10CO2↑+22++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000
mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
①此步操作过程中一定需要用到下列哪些仪器(填写序号)B、C、D;

②达到滴定终点时,溶液的颜色变化是无色变为紫色或高锰酸钾溶液不褪色;
③滴定到终点,静置后,如图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高 (填“偏高”、“偏低”、“无影响”).
(5)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是KSCN溶液,溶液呈红色.
(6)原茶叶中钙元素的质量分数为0.2%.