题目内容
2.常压、100℃时,等质量的SO2气体和SO3气体的密度之比为4:5,原子数之比为15:16,体积之比5:4.分析 根据质量计算气体的物质的量,可得物质的量之比,根据分子组成可得原子数之比,同温同压下,气体的物质的量之比等于体积之比,密度之比等于相对分子质量之比,根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算.
解答 解:由n=$\frac{m}{M}=\frac{V}{{V}_{m}}$可知,$ρ=\frac{m}{V}=\frac{M}{{V}_{m}}$,在相同条件下气体的相对分子质量之比等于密度之比,所以两种气体的密度之比为:64:80=4:5,
设气体的质量为m,则n(SO2)=$\frac{m}{64}$mol,n(SO3)=$\frac{m}{80}$mol,所以物质的量之比为=$\frac{m}{64}$:$\frac{m}{80}$=80:64=5:4,
根据分子组成可知,两种气体的原子数之比为:5×3:4×4=15:16,
根据V=n•Vm可知,同温同压下,气体的物质的量之比等于体积之比,所以两种气体体积之比等于5:4,
故答案为:4:5;15:16;5:4.
点评 本题考查阿伏加德罗定律及推论,题目难度中等,注意物质的量与体积、密度、原子数目的计算公式的运用.

练习册系列答案
相关题目
13.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了27g.常温下各烧杯中溶液的pH与电解时间(t)的关系如图2.据此回答下列问题:
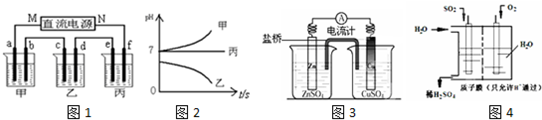
(1)M为电源的负极(填“正”或“负”),甲电解质为NaCl(填化学式).
(2)写出丙烧杯中反应的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
(3)有人设想用图3所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的M(填“M”或“N”)极.
(4)有人设想用图4所示装置做直流电源,不仅可以完成电解也能将气体SO2转化为重要化工原料.该设想中负极的电极反应式为SO2+2H2O-2e-=4H++SO42-.
(5)以甲醇、空气,氢氧化钾溶液为原料,石墨为电极,可构成燃料电池;已知该燃料电池的总反应式是:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时,正极区溶液的PH增大 (填“增大”,“减小”或“不变”)该电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
(6)用上述燃料电池进行粗铜的精炼,粗铜应连接电源的正极,该粗铜精炼电解池的阴极反应式为Cu2++2e-=Cu.
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

(1)M为电源的负极(填“正”或“负”),甲电解质为NaCl(填化学式).
(2)写出丙烧杯中反应的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
(3)有人设想用图3所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的M(填“M”或“N”)极.
(4)有人设想用图4所示装置做直流电源,不仅可以完成电解也能将气体SO2转化为重要化工原料.该设想中负极的电极反应式为SO2+2H2O-2e-=4H++SO42-.
(5)以甲醇、空气,氢氧化钾溶液为原料,石墨为电极,可构成燃料电池;已知该燃料电池的总反应式是:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时,正极区溶液的PH增大 (填“增大”,“减小”或“不变”)该电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
(6)用上述燃料电池进行粗铜的精炼,粗铜应连接电源的正极,该粗铜精炼电解池的阴极反应式为Cu2++2e-=Cu.
10.给试管里的固体加热,下列操作中错误的是( )
| A. | 如试管外壁有水,应在加热前擦拭干净 | |
| B. | 试管均匀受热,即先进行预热,然后把灯焰固定在放固体的部位加热 | |
| C. | 加热时不要使试管与灯心相接触 | |
| D. | 加热完毕,立即用冷水冲洗试管 |
17.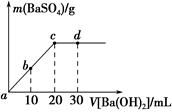 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )| A. | 硫酸氢钠溶液的体积为10 mL | |
| B. | 溶液的导电能力:c<b<a | |
| C. | d时刻溶液的pH为13 | |
| D. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 |
7.下列除去杂质方法正确的是( )
| A. | 除去CO2中混有的CO:用浓NaOH溶液洗气 | |
| B. | 除去BaCO3固体中混有的BaSO4:加过量稀盐酸后,过滤、洗涤 | |
| C. | 除去KNO3溶液中混有的NaCl:蒸发结晶 | |
| D. | 除去Cu粉中混有的CuO:加适量稀硫酸后,过滤、洗涤 |
11.如图所示微观变化的化学反应类型,与下列反应的反应类型一致的是( )
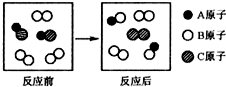

| A. | 2KClO3 $\frac{\underline{MnO_2}}{△}$2KCl+3O2 | B. | 2HI+Cl2═2HCl+I2 | ||
| C. | CO2+C $\frac{\underline{\;高温\;}}{\;}$2CO | D. | 2HCl+CuO═CuCl2+H2O |
 .
.