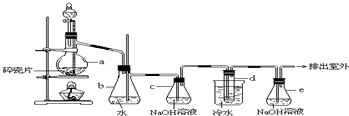
15.下列叙述中正确的是( )
| A. | 电能是二级能源 | B. | 水力是二级能源 | ||
| C. | 天然气是二级能源 | D. | 焦炉气是一级能源 |
14.由氢气和氧气反应生成1mol水蒸气放热241.8kJ,则反应2H2(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2H2O(g)的△H为( )
| A. | -483.6kJ•mol-1 | B. | -241.8kJ•mol-1 | C. | -120.6kJ•mol-1 | D. | +241.8kJ•mol-1 |
11.将4.6g有机物完全燃烧,生成CO2和H2O,该有机物完全燃烧产物通过浓硫酸,浓硫酸增重5.4g,再通过碱石灰,又增重8.8g.则该有机物的分子式为( )
| A. | C4H10 | B. | C2H6O | C. | C3H8O | D. | C2H4O2 |
9.常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3•H2O溶液.下列说法正确的是( )
| A. | 同物质的量浓度的三种溶液的pH:a>b>c | |
| B. | 同pH时,三种溶液稀释相同倍数后,pH:a>b<c | |
| C. | 同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c | |
| D. | 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
8.下列说法中错误的是( )
| A. | 弱电解质的电离是一个吸热过程,升温其电离度增大 | |
| B. | 某些盐类的水解是一个吸热过程,升温水解程度增大 | |
| C. | 溶液的酸碱性取决于溶液中氢离子浓度的大小 | |
| D. | 酸性溶液不一定是酸溶液,碱性溶液不一定是碱溶液 |
6.下列说法中正确的是( )
0 172187 172195 172201 172205 172211 172213 172217 172223 172225 172231 172237 172241 172243 172247 172253 172255 172261 172265 172267 172271 172273 172277 172279 172281 172282 172283 172285 172286 172287 172289 172291 172295 172297 172301 172303 172307 172313 172315 172321 172325 172327 172331 172337 172343 172345 172351 172355 172357 172363 172367 172373 172381 203614
| A. | 1s、2px、2py、2pz轨道都具有球对称性 | |
| B. | 因为p轨道是“8”字形的,所以p电子也是“8”字形 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个轨道 | |
| D. | 原子轨道示意图与电子云图都是用来形象描述电子运动状态的图形 |
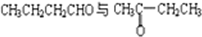 B.
B.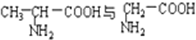 C.
C.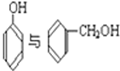 D.CH3CH2C≡CH与CH2═CH-CH═CH2E.
D.CH3CH2C≡CH与CH2═CH-CH═CH2E.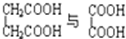 F.戊烯和戊烷
F.戊烯和戊烷 表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3,名称是2-甲基戊烷.
表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3,名称是2-甲基戊烷.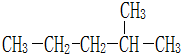 :2-甲基戊烷;
:2-甲基戊烷;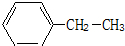 乙苯
乙苯 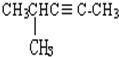 4-甲基-2-戊炔.
4-甲基-2-戊炔.