15.以甲烷为初始原料制取氢气,是一项比较成熟的技术,下面是制取氢气的流程图如图1,根据信息回答下列问题:
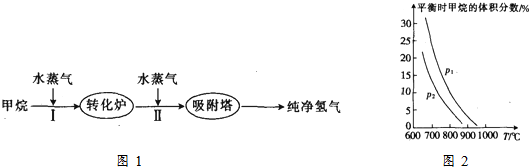
(1)阶段I发生的反应为CH4(g)+H2O(g)?CO(g)+3H2(g).
①写出该反应的平衡常数表达式$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$;
②已知在“水碳比”$\frac{c({H}_{2}O)}{c(C{H}_{4})}$=3时,测得温度(T )和压强(p)对上述反应的影响如图2所示.则升高温度,该反应的平衡常数K增大(填“增大”、“减小”或“不变”),据图可知P1>P2.(填“>”、“<”或“=”)
(2)阶段Ⅱ发生的反应为CO(g)+H2O(g)?CO2(g)+H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如表所示(表中t1<t2):
①保持T1温度不变,若向原容器中通入 0.60mol CO和1.20mol H2O(g),则达到平衡后n(CO2)=0.4mol.
②若达到平衡后,保持其他条件不变,只是向原平衡体系中再通入0.20mol H2O(g),则下列说法正确的是ab.
a、CO的转化率将增大 b、H2O(g)的体积分数将增大
c、气体的密度将不变 d、化学平衡常数将增大.

(1)阶段I发生的反应为CH4(g)+H2O(g)?CO(g)+3H2(g).
①写出该反应的平衡常数表达式$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$;
②已知在“水碳比”$\frac{c({H}_{2}O)}{c(C{H}_{4})}$=3时,测得温度(T )和压强(p)对上述反应的影响如图2所示.则升高温度,该反应的平衡常数K增大(填“增大”、“减小”或“不变”),据图可知P1>P2.(填“>”、“<”或“=”)
(2)阶段Ⅱ发生的反应为CO(g)+H2O(g)?CO2(g)+H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如表所示(表中t1<t2):
| 反应时间(min) | n(CO)(mol) | N(H2O)(mol) |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
②若达到平衡后,保持其他条件不变,只是向原平衡体系中再通入0.20mol H2O(g),则下列说法正确的是ab.
a、CO的转化率将增大 b、H2O(g)的体积分数将增大
c、气体的密度将不变 d、化学平衡常数将增大.
14. 在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.
(2)该反应为放热反应(填“吸热”或“放热”).
(3)增加H2O(g)的浓度,CO的转化率将增大(填“增大”、“减小”或“不变”).
(4)830℃时,向该容器中加入2molCO2与2molH2,平衡时CO2的体积分数是25%.
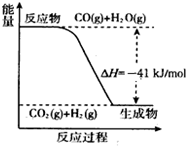
(5)已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.又已知2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol. 结合图象写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol.
 在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 |
| K | 2.6 | 1.7 | 1.0 | 0.9 |
(1)该反应的化学平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.
(2)该反应为放热反应(填“吸热”或“放热”).
(3)增加H2O(g)的浓度,CO的转化率将增大(填“增大”、“减小”或“不变”).
(4)830℃时,向该容器中加入2molCO2与2molH2,平衡时CO2的体积分数是25%.
(5)已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.又已知2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol. 结合图象写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol.
13.正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
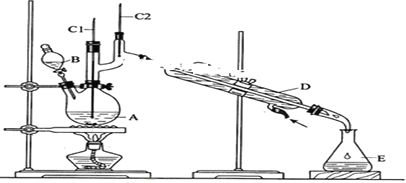
发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}CrO_{7}}$CH3CH2CH2CHO反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95.C,在E中收集90.C以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77.C馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中?不能 (填“能”或“不能”)说明理由容易发生迸溅.
(2)加入沸石的作用是防止暴沸.
(3)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”
(5)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(6)本实验中,正丁醛的产率为51.4%.

发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}CrO_{7}}$CH3CH2CH2CHO反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95.C,在E中收集90.C以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77.C馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中?不能 (填“能”或“不能”)说明理由容易发生迸溅.
(2)加入沸石的作用是防止暴沸.
(3)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”
(5)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(6)本实验中,正丁醛的产率为51.4%.
8.已知某温度下反应2A(s)+3B(g)?3C(g)+D(s)△H<0的平衡常数为64.此温度下,在一个容积为2L的密闭容器中加入A、B、C、D各2.0mol,10min后反应达到平衡.下列说法正确的是( )
| A. | 该反应的平衡常数表达式为k=$\frac{{c}^{3}(C)•c(D)}{{c}^{2}(A)•{c}^{3}(B)}$ | |
| B. | 升高温度,该反应的平衡常数增大 | |
| C. | 从反应开始10min,该反应的平均反应速率v(C)为0.12mol/(L•min) | |
| D. | B的平衡转化率为60% |
6.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+S(l)
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率v(CO2)=0.77mol/(L•s).
(3)在该温度下,反应的平衡常数K=3.33×1036.
(4)假设在密闭容器中发生上述反应,达到平衡时,下列措施既不会提高成本,又能提高SO2转化率的是BC.
A.选用更有效的催化剂 B.提高n(CO):n(SO2)投料比
C.降低反应体系的温度 D.缩小容器的体积
(5)为了分别验证不同催化剂、温度、浓度对化学反应速率的影响规律,某同学设计了四组实验使反应速率依次增大,部分实验条件已经填在下面实验设计表中.
①请将上述表格中剩余的实验条件数据填入答题卷相应位置.
②研究表明:Fe2O3的催化效果好于Cr2O3.请在答题卷相应位置画出上表中的四个实验条件下混合气体中SO2浓度随时间变化的趋势曲线图,并标明各实验编号.
0 172185 172193 172199 172203 172209 172211 172215 172221 172223 172229 172235 172239 172241 172245 172251 172253 172259 172263 172265 172269 172271 172275 172277 172279 172280 172281 172283 172284 172285 172287 172289 172293 172295 172299 172301 172305 172311 172313 172319 172323 172325 172329 172335 172341 172343 172349 172353 172355 172361 172365 172371 172379 203614
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(SO2)(mol•L-1) | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 | 3.00×10-37 |
| c(CO)(mol•L-1) | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 | 2.00 |
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率v(CO2)=0.77mol/(L•s).
(3)在该温度下,反应的平衡常数K=3.33×1036.
(4)假设在密闭容器中发生上述反应,达到平衡时,下列措施既不会提高成本,又能提高SO2转化率的是BC.
A.选用更有效的催化剂 B.提高n(CO):n(SO2)投料比
C.降低反应体系的温度 D.缩小容器的体积
(5)为了分别验证不同催化剂、温度、浓度对化学反应速率的影响规律,某同学设计了四组实验使反应速率依次增大,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | SO2初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂 |
| Ⅰ | 260 | 1.00 | 3.00 | Cr2O3 |
| Ⅱ | Fe2O3 | |||
| Ⅲ | 380 | |||
| Ⅳ | 4.00 |
②研究表明:Fe2O3的催化效果好于Cr2O3.请在答题卷相应位置画出上表中的四个实验条件下混合气体中SO2浓度随时间变化的趋势曲线图,并标明各实验编号.
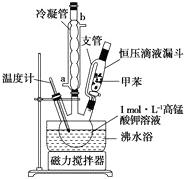 苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下:
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$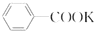 +KOH+2MnO2+H2O
+KOH+2MnO2+H2O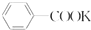 +HCl→
+HCl→ +KCl
+KCl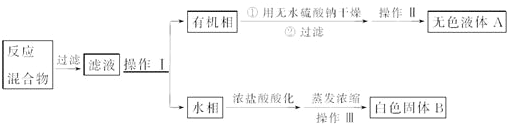
 →合成→水热处理→过滤→水洗→表面处理→过滤水洗→干燥
→合成→水热处理→过滤→水洗→表面处理→过滤水洗→干燥 某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH
某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH
