19.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O═KIO3+3H2↑.下列有关说法正确的是( )
| A. | 电解时,石墨作阴极,不锈钢作阳极 | |
| B. | 电解时,阳极反应是:I--6e-+3H2O═IO3-+6H+ | |
| C. | 溶液调节至强酸性,对生产有利 | |
| D. | 电解时溶液中I-向阴极迁移 |
18.下列液体均处于25℃,有关叙述不正确的是( )
| A. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| B. | 某物质的溶液pH<7,则该物质一定是酸 | |
| C. | pH=7的某溶液一定呈中性 | |
| D. | pH=7.6的氨水,c(H+)>10-7mol/L |
17.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e-═2CO32-+12H2O,7H2O+$\frac{7}{2}$O2+14e-═14OH-,有关此电池的推断正确的是( )
| A. | 电解质溶液中电子向正极移动 | |
| B. | 放电一段时间后,KOH的物质的量浓度不变 | |
| C. | 通乙烷的电极为负极 | |
| D. | 参加反应的O2和C2H6的物质的量之比为2:7 |
16.5.6 g铁粉投入到盛有100 mL 2 mol/L稀硫酸的烧杯中,2 min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是( )
| A. | v(Fe)=0.5 mol/(L•min) | B. | v(H2SO4)=1 mol/(L•min) | ||
| C. | v(H2SO4)=0.5 mol/(L•min) | D. | v(FeSO4)=1 mol/(L•min) |
14.甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:(已知 氨可以与灼热的氧化铜反应得到氮气和金属铜.方程式见下):
[制取氨气]→[装有足量干燥剂的干燥管]→装有氧化铜的硬质玻管]→[装有足量浓硫酸的洗气瓶]→[测定生成]
氮的体积制取氨气装有足量干燥剂的 干 燥 管装有氧化铜的硬质玻管装有足量浓硫酸的洗气瓶 测定生成氮的体积
3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O
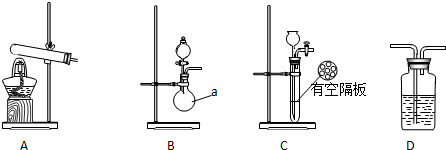
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L. 请回答下列问题:
(1)写出仪器a的名称圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为5V1:7(m1-m2).
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
[制取氨气]→[装有足量干燥剂的干燥管]→装有氧化铜的硬质玻管]→[装有足量浓硫酸的洗气瓶]→[测定生成]
氮的体积制取氨气装有足量干燥剂的 干 燥 管装有氧化铜的硬质玻管装有足量浓硫酸的洗气瓶 测定生成氮的体积
3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L. 请回答下列问题:
(1)写出仪器a的名称圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4. |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 分析氢氧化钠的作用:③氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出. |
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
12.下列各元素的原子在形成不同物质时,既能形成非极性键,也能形成极性键,还能形成离子键的是.( )
0 172110 172118 172124 172128 172134 172136 172140 172146 172148 172154 172160 172164 172166 172170 172176 172178 172184 172188 172190 172194 172196 172200 172202 172204 172205 172206 172208 172209 172210 172212 172214 172218 172220 172224 172226 172230 172236 172238 172244 172248 172250 172254 172260 172266 172268 172274 172278 172280 172286 172290 172296 172304 203614
| A. | Na | B. | Fe | C. | O | D. | Ar |
 ,用电子式表示A与B形成的三原子分子的形成过程
,用电子式表示A与B形成的三原子分子的形成过程 .
.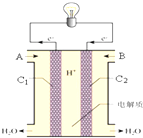 氢氧燃料电池已用于航天飞机.如图为氢氧燃料电池构造示意图,其中A、B为气体进口,C1、C2均为石墨电极,电解质溶液为30%的氢氧化钾溶液.
氢氧燃料电池已用于航天飞机.如图为氢氧燃料电池构造示意图,其中A、B为气体进口,C1、C2均为石墨电极,电解质溶液为30%的氢氧化钾溶液.