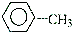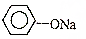3.下列有机反应类型判断错误的是:( )
| A. | ClCH2CH2Cl+2CH3NH2→CH3NHCH2CH2NHCH3+2HCl 取代反应 | |
| B. |  加成反应 加成反应 | |
| C. |  消去反应 消去反应 | |
| D. |  加聚反应 加聚反应 |
20.只用一种试剂来鉴别碳酸钠、亚硫酸钠、硫酸钠,这种试剂可以是( )
| A. | BaCl2 | B. | 溴水 | C. | 稀盐酸 | D. | 品红溶液 |
19.实验室所需某些溶液中,宜随用随配、不宜长久存放的是( )
①稀盐酸 ②氯水 ③亚硫酸 ④氢硫酸.
①稀盐酸 ②氯水 ③亚硫酸 ④氢硫酸.
| A. | 只有①② | B. | 只有②③④ | C. | 只有②④ | D. | ①②③④ |
18.下列离子中最外层电子数为8的是( )
| A. | Ga3+ | B. | Ti4+ | C. | Cu+ | D. | Li+ |
17.太阳能是一种应用广泛的绿色能源.如图是太阳能电池经太阳光照射前和太阳光照射时内部电子的变化情况.图乙中灯泡变亮.关于该过程的描述正确的是( )


| A. | 该过程光能变为化学能再变为电能 | B. | 太阳能电池可以用高纯硅制造 | ||
| C. | N为电子流入的一极 | D. | 用该电池精炼铜时粗铜与N极连接 |
15.某草酸亚铁样品(FeC2O4•xH2O)中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:5Fe2++5C2O42-+3MnO4-+24H+═5Fe3++10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后,继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为cmL
③重复以上实验1-2次.
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是重复以上实验1-2次.
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.检验活塞是否漏水.
Ⅱ.用高锰酸钾标准溶液润洗滴定管.
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有KSCN溶液的试管中,如溶液中没有出现血红色(或红色),则说明溶液合格.
(4)某小组的一次测定数据记录如表:
根据数据计算0.1970g 样品中:n(Fe2+)═0.001110mol; n(C2O42-)═0.001010mol;FeC2O4 的质量分数为73.81%(精确到0.01%).
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后,继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为cmL
③重复以上实验1-2次.
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是重复以上实验1-2次.
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.检验活塞是否漏水.
Ⅱ.用高锰酸钾标准溶液润洗滴定管.
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有KSCN溶液的试管中,如溶液中没有出现血红色(或红色),则说明溶液合格.
(4)某小组的一次测定数据记录如表:
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |
14.向NaCN的水溶液中加入下列物质,可使NaCN水解程度增大的是( )
①NaOH ②NaCN ③NH4Cl ④Na2CO3 ⑤H2O ⑥HCN ⑦HCl.
0 172052 172060 172066 172070 172076 172078 172082 172088 172090 172096 172102 172106 172108 172112 172118 172120 172126 172130 172132 172136 172138 172142 172144 172146 172147 172148 172150 172151 172152 172154 172156 172160 172162 172166 172168 172172 172178 172180 172186 172190 172192 172196 172202 172208 172210 172216 172220 172222 172228 172232 172238 172246 203614
①NaOH ②NaCN ③NH4Cl ④Na2CO3 ⑤H2O ⑥HCN ⑦HCl.
| A. | ①②③ | B. | ①⑤⑥ | C. | ①③⑤ | D. | ③⑤⑦ |