题目内容
2.今有长期盛放的Na2SO3(其中可能含有氧化产物Na2SO4),为测定其纯度,取样品3.5g和某浓度的盐酸100mL恰好完全反应,气体全部逸出后体积为280mL(标况).求:(1)原Na2SO3的纯度;
(2)所用盐酸的物质的量浓度.
分析 (1)亚硫酸钠可以和盐酸之间反应生成二氧化硫气体,根据方程式结合产生气体的量计算亚硫酸钠的物质的量,进而计算其纯度;
(2)亚硫酸钠可以和盐酸之间反应生成二氧化硫气体,根据方程式结合产生气体的量计算消耗盐酸的物质的量,进而计算浓度.
解答 解:(1)亚硫酸钠可以和盐酸之间反应生成二氧化硫气体,气体全部逸出后体积为280mL(标况),物质的量为:$\frac{0.28L}{22.4L/mol}$=0.0125mol,根据反应:Na2SO3+2HCl=NaCl+H2O+SO2↑,消耗亚硫酸钠的物质的量是0.0125mol,质量是0.0125mol×126g/mol=1.575g,原Na2SO3的纯度=$\frac{1.575g}{3.5g}$×100%=45%,
答:原Na2SO3的纯度是45%;
(2)根据反应:Na2SO3+2HCl=NaCl+H2O+SO2↑,消耗盐酸的物质的量是0.0125mol×2=0.025mol,浓度是$\frac{0.025mol}{0.1L}$=0.25mol/L,
答:所用盐酸的物质的量浓度是0.25mol/L.
点评 本题考查学生化学方程式的有关计算以及物质的量浓度的计算知识,属于化学方程式的计算题,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.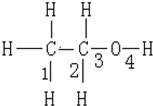 乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示.当乙醇和氧气发生催化氧化时,化学键断裂的位置是 ( )
乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示.当乙醇和氧气发生催化氧化时,化学键断裂的位置是 ( )
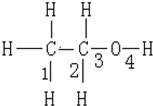 乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示.当乙醇和氧气发生催化氧化时,化学键断裂的位置是 ( )
乙醇在一定的条件下发生化学反应时,化学键断裂的情况如图所示.当乙醇和氧气发生催化氧化时,化学键断裂的位置是 ( )| A. | 2 3 | B. | 2 4 | C. | 1 3 | D. | 3 4 |
10.下列叙述正确的是( )
| A. | 将氯化铁饱和溶液逐滴滴入氢氧化钠稀溶液中,边滴边搅拌,可获得氢氧化铁胶体 | |
| B. | 不能用乙醇萃取碘水中的碘是因为碘在水中溶解度比在乙醇中大 | |
| C. | 实验室可通过蒸馏的方法除去自来水中含有的氯离子等杂质制蒸馏水 | |
| D. | 定容时俯视容量瓶的刻度线会导致所配制的溶液浓度偏低 |
17.太阳能是一种应用广泛的绿色能源.如图是太阳能电池经太阳光照射前和太阳光照射时内部电子的变化情况.图乙中灯泡变亮.关于该过程的描述正确的是( )


| A. | 该过程光能变为化学能再变为电能 | B. | 太阳能电池可以用高纯硅制造 | ||
| C. | N为电子流入的一极 | D. | 用该电池精炼铜时粗铜与N极连接 |
7.工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g).已知在25℃时:
C(石墨)+$\frac{1}{2}$O2(g)═CO(g)△H=-111kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol
C(石墨)+O2(g)═CO2(g)△H=-394kJ/mol
则25℃时1mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为( )
C(石墨)+$\frac{1}{2}$O2(g)═CO(g)△H=-111kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol
C(石墨)+O2(g)═CO2(g)△H=-394kJ/mol
则25℃时1mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为( )
| A. | +41.kJ/mol | B. | -41kJ/mol | C. | 283kJ/mol | D. | -131kJ/mol |
14.对4FeCl2+4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8NaCl,下列说法错误的是( )
| A. | 用于氧化FeCl2的Na2O2占全部的Na2O2一半 | |
| B. | 氧气是氧化产物 | |
| C. | 氢氧化铁是氧化产物,氧气是还原产物 | |
| D. | 做氧化剂的过氧化钠和做还原剂的过氧化钠物质的量之比为3:1 |
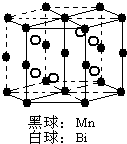 氮磷砷锑铋位于周期表第ⅤA族,它们的单质及其化合物在社会生产生活中有广泛应用,请回答有关问题:
氮磷砷锑铋位于周期表第ⅤA族,它们的单质及其化合物在社会生产生活中有广泛应用,请回答有关问题: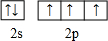 .
.
 .
.