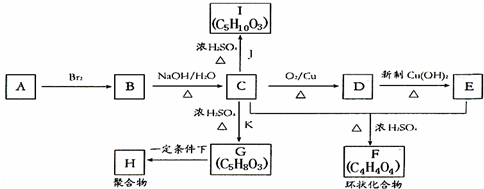
5.铬(Cr)是重要的金属元素.
不同铬的化合物或离子的水溶液的颜色如下:
含铬元素的化合物可以发生如下一系列变化:

(1)反应①的还原剂是Zn,反应②的离子方程式为Cr3++3OH-═Cr(OH)3↓.
(2)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(3)将KCl和CrCl3两种固体混合物共熔制得化合物X,将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
另取0.0035mol X溶于水中,当加入0.0315mol AgNO3时,恰好沉淀完全.则表示X组成的化学式为K3Cr2Cl9.
不同铬的化合物或离子的水溶液的颜色如下:
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr(OH)4- | Cr3+ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 绿色 | 绿色 | 黄色 |

(1)反应①的还原剂是Zn,反应②的离子方程式为Cr3++3OH-═Cr(OH)3↓.
(2)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(3)将KCl和CrCl3两种固体混合物共熔制得化合物X,将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
另取0.0035mol X溶于水中,当加入0.0315mol AgNO3时,恰好沉淀完全.则表示X组成的化学式为K3Cr2Cl9.
3.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4═3N2↑+4H2O,反应温度可高达2700℃,若有1mol N2H4被氧化,则下列判断不正确的是( )
| A. | 生成33.6LN2(标准状况下) | B. | 被还原的N原子的物质的量为2mol | ||
| C. | 转移电子的物质的量为4 mol | D. | 还原产物比氧化产物多0.5mol |
2.X、Y、Z、W、Q均为短周期元素,其中Y、Z、W、Q在元素周期表中的相对位置,X是周期表中原子半径最小的元素,Q的原子序数是W的2倍.
(1)Z原子的结构示意图为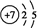 ,化合物X2Q的电子式为
,化合物X2Q的电子式为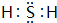 .
.
(2)可溶性盐(ZX4)2Q2W8是强氧化剂,可将二价锰离子氧化为高锰酸根离子,所得溶液呈强酸性,写出该反应的离子方程式:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+.
(3)一定条件下,向容积不变的密闭容器中充入a mol QW2与b mol YW,发生反应生成YW2和液态Q单质,反应达到平衡时转移2.5mol电子,同时放出85kJ热量,则该反应的热化学方程式为SO2(g)+2CO(g) 2CO2(g)+S(l)△H=-136 kJ•mol-1,欲使YW的平衡转化率大于QW2的平衡转化率,则a与b的关系为a:b>1:2.
2CO2(g)+S(l)△H=-136 kJ•mol-1,欲使YW的平衡转化率大于QW2的平衡转化率,则a与b的关系为a:b>1:2.
| Y | Z | W |
| Q |
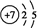 ,化合物X2Q的电子式为
,化合物X2Q的电子式为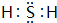 .
.(2)可溶性盐(ZX4)2Q2W8是强氧化剂,可将二价锰离子氧化为高锰酸根离子,所得溶液呈强酸性,写出该反应的离子方程式:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+.
(3)一定条件下,向容积不变的密闭容器中充入a mol QW2与b mol YW,发生反应生成YW2和液态Q单质,反应达到平衡时转移2.5mol电子,同时放出85kJ热量,则该反应的热化学方程式为SO2(g)+2CO(g)
 2CO2(g)+S(l)△H=-136 kJ•mol-1,欲使YW的平衡转化率大于QW2的平衡转化率,则a与b的关系为a:b>1:2.
2CO2(g)+S(l)△H=-136 kJ•mol-1,欲使YW的平衡转化率大于QW2的平衡转化率,则a与b的关系为a:b>1:2.
19.X、Y、Z三种短周期元素在周期表中的位置如表所示.若X的最高正价与最低负价的代数和为2,则下列说法正确的是( )
| X | Z | |
| Y |
| A. | 原子序数由大到小为 Z>Y>X | |
| B. | 氢化物最稳定的元素为Y | |
| C. | X的最高价氧化物对应的水化物的稀溶液能与铜发生反应 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
17.某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
(1)实验目的:研究同周期元素性质的递变规律.
(2)实验用品:
试剂:金属钠,镁条、铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞试液等.
仪器:①小刀,②胶头滴管,③酒精灯,试管,试管夹,烧杯,镊子,玻璃片,砂纸,滤纸,火柴等.
(3)实验内容:实验②对应的现象:(填相应字母);实验⑥对应的离子反应是Al3++4OH-=AlO2-+2H2O
(4)实验所有实验步骤最终得出的结论是:金属性:Na>Mg>Al 非金属性:Cl>S.
0 171922 171930 171936 171940 171946 171948 171952 171958 171960 171966 171972 171976 171978 171982 171988 171990 171996 172000 172002 172006 172008 172012 172014 172016 172017 172018 172020 172021 172022 172024 172026 172030 172032 172036 172038 172042 172048 172050 172056 172060 172062 172066 172072 172078 172080 172086 172090 172092 172098 172102 172108 172116 203614
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞试液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③用小刀切割一小块钠擦干煤油后放入滴有酚酞试液的装有冷水的烧杯中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将打磨后的镁投入装有稀盐酸的试管中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将打磨后的铝投入装有稀盐酸的试管中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:研究同周期元素性质的递变规律.
(2)实验用品:
试剂:金属钠,镁条、铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞试液等.
仪器:①小刀,②胶头滴管,③酒精灯,试管,试管夹,烧杯,镊子,玻璃片,砂纸,滤纸,火柴等.
(3)实验内容:实验②对应的现象:(填相应字母);实验⑥对应的离子反应是Al3++4OH-=AlO2-+2H2O
(4)实验所有实验步骤最终得出的结论是:金属性:Na>Mg>Al 非金属性:Cl>S.
 已知在酸性条件下有以下反应:①2BrO3-+I2═2IO3-+Br2;②2IO3-+10Br-+12H+═I2+5Br2+6H2O.
已知在酸性条件下有以下反应:①2BrO3-+I2═2IO3-+Br2;②2IO3-+10Br-+12H+═I2+5Br2+6H2O.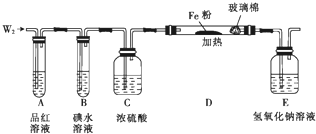
 ,该化合物中含有的化学键有离子键、共价键
,该化合物中含有的化学键有离子键、共价键
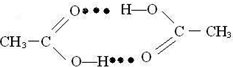 .
.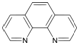 ),它能与Fe2+形成红色配合物(如右图2),
),它能与Fe2+形成红色配合物(如右图2),