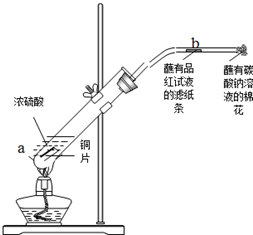
9.下列有关化学用语表示正确的是( )
| A. | 赤铁矿的主要成份的化学式:Fe3O4 | |
| B. | 次氯酸的电离方程式:HClO=H++ClO- | |
| C. | 氯离子的结构示意图: | |
| D. | 中子数为14的铝原子:${\;}_{13}^{14}$Al |
8.化学与社会、生产、生活紧切相关.下列说法不正确的是( )
| A. | 人体缺铁会引起贫血等疾病 | |
| B. | 任何条件下,铝不与浓硫酸、浓硝酸反应,因此浓硫酸、浓硝酸可储存于铝制的容器中 | |
| C. | 明矾溶于水会产生氢氧化铝胶体,故可用作净水剂 | |
| D. | 铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂 |
6.有些化学反应反应速率很慢且副反应较多,测定这些反应的焓变可运用( )
| A. | 盖斯定律 | B. | 勒夏特列原理 | C. | 阿伏加德罗定律 | D. | 质量守恒定律 |
5.合成氨反应为:3H2+N2→2NH3,当反应达到平衡时,其反应速率可以分别用V(H2),V(N2),V(NH3)表示,则正确的关系式是( )
| A. | v(H2)=v(N2)=v(NH3) | B. | v(H2)=3v(N2) | C. | v(NH3)=3(H2) | D. | v(N2)=3V(H2) |
4.已知主族元素A、B、C、D的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-具有相同的电子层结构.则下列叙述正确的是(n为正整数)( )
| A. | 原子序数:a<b<d<c | |
| B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | |
| C. | 单质的还原性:B>A;单质的氧化性:D>C | |
| D. | 离子的还原性:A(n+1)+>Bn+;离子的氧化性:C(n+1)->Dn- |
3.铁的发现和大规模使用,是人类发展史上的一个光辉里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展.
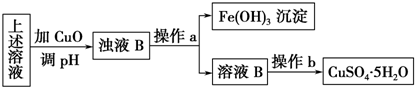
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:
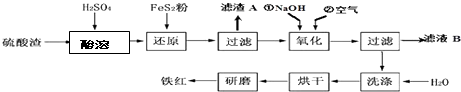
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
0 171902 171910 171916 171920 171926 171928 171932 171938 171940 171946 171952 171956 171958 171962 171968 171970 171976 171980 171982 171986 171988 171992 171994 171996 171997 171998 172000 172001 172002 172004 172006 172010 172012 172016 172018 172022 172028 172030 172036 172040 172042 172046 172052 172058 172060 172066 172070 172072 172078 172082 172088 172096 203614
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
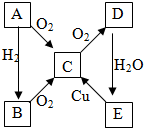 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.