2.烯烃在一定条件下发生氧化反应时,碳碳双键断裂,如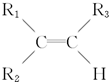 被氧化为
被氧化为 和
和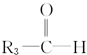 ,由此推断某烯烃氧化后生成两分子CH3CHO和一分子
,由此推断某烯烃氧化后生成两分子CH3CHO和一分子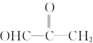 ,则原烯烃是( )
,则原烯烃是( )
 被氧化为
被氧化为 和
和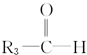 ,由此推断某烯烃氧化后生成两分子CH3CHO和一分子
,由此推断某烯烃氧化后生成两分子CH3CHO和一分子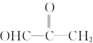 ,则原烯烃是( )
,则原烯烃是( )| A. | CH2═CHCH2CH(CH3)CH═CH2 | B. | CH3CH═CH-CH═C(CH3)2 | ||
| C. | CH3CH═CHC(CH3)═CHCH3 | D. | CH3CH═CHCH═CHCH(CH3)2 |
1.下列离子方程式书写正确的是( )
| A. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| C. | Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+═Fe2++2H2O | |
| D. | H218O2中加入H2SO4酸化的KMnO4 5H218O2+2MnO4-+6H+═518O2+2Mn2++8H2O |
20.同温同压下,具有相同原子数的下列各组气体,体积也相同的是( )
| A. | 氢气和氦气 | B. | 一氧化碳和氮气 | C. | 二氧化碳和氨气 | D. | 甲烷和氨气 |
19.下列说法错误的是( )
| A. | 硫酸的摩尔质量是98克 | |
| B. | 阿伏加德常数个微粒的物质的量是1mol | |
| C. | 1mol 12C原子的质量为12g | |
| D. | 6.02×1023mol-1是阿伏加德罗常数的近似值 |
16.关于水的离子积常数,下列说法不正确的是( )
| A. | 100℃水中,c(H+)•c(OH-)=1×10-14 | |
| B. | 纯水中,25℃时,c(H+)•c(OH-)=1×10-14 | |
| C. | 25℃时,任何以水为溶剂的稀溶液中c(H+)•c(OH-)=1×10-14 | |
| D. | KW值随温度升高而增大 |
14.己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大.X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍.下列说法不正确的是( )
| A. | N的单质的晶体属于金属晶体;U的氢化物的球棍模型示意图为 | |
| B. | 工业上V的单质的制备可以电解熔融的NV | |
| C. | Z的最高价氧化物对应的水化物能与其气态氢化物反应生成盐 | |
| D. | X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物;也可形成结构式为X-W-Y≡Z的化合物 |
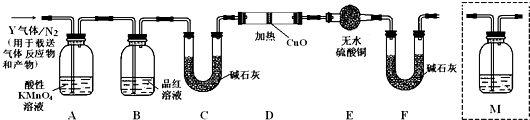
13.下列操作中不正确的是( )
0 171875 171883 171889 171893 171899 171901 171905 171911 171913 171919 171925 171929 171931 171935 171941 171943 171949 171953 171955 171959 171961 171965 171967 171969 171970 171971 171973 171974 171975 171977 171979 171983 171985 171989 171991 171995 172001 172003 172009 172013 172015 172019 172025 172031 172033 172039 172043 172045 172051 172055 172061 172069 203614
| A. | 过滤时玻璃棒与三层滤纸处接触 | |
| B. | 酒精和水的混合物可以通过蒸馏将二者分离开来 | |
| C. | 向试管中滴加液体时,胶头滴管应紧贴试管内壁 | |
| D. | KNO3中混有少量的NaCl,可通过重结晶实验将杂质出去 |