15.下列叙述中正确的是( )
| A. | 原子晶体中,共价键的键能越大,熔沸点越高 | |
| B. | 分子晶体中,分子间的作用力越大,该分子越稳定 | |
| C. | 分子晶体中,共价键的键能越大,熔沸点越高 | |
| D. | 原子晶体中,构成晶体的微粒一定是相同的原子 |
14.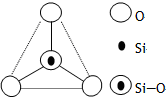 如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )
如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )
 如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )
如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )| A. | 键角为120℃ | B. | 化学组成为SiO32- | ||
| C. | 键角为60° | D. | 化学组成为SiO44- |
12.氢氧燃料电池是一种新能源.图为氢氧燃料电池示意图.下列说法不正确的是( )
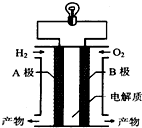

| A. | 电子由B极通过导线流向A极 | |
| B. | A极是负极,B极是正极 | |
| C. | 该装置能将化学能转化为电能 | |
| D. | 产物为无污染的水,属于环境友好电池 |
11.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | lmol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 乙烯和丙烯组成的42 g混合气体中氢原子的个数为6 NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 2 L0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA |
9. 断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:
断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为放热(填“吸热”或“放热”)反应,其中△H=(a-b) kJ•mol-1(用含有a、b的关系式表示).
(2)若图示中表示反应H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,则b=926kJ•mol-1,O═O 键的键能x=496.4.
 断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:
断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:| 化学键 | H-H | Cl-Cl | O═O | C-Cl | C-H | O-H | H-Cl |
| E/kJ•mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应为放热(填“吸热”或“放热”)反应,其中△H=(a-b) kJ•mol-1(用含有a、b的关系式表示).
(2)若图示中表示反应H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,则b=926kJ•mol-1,O═O 键的键能x=496.4.
8.在测定中和热的实验中,下列说法正确的是( )
| A. | 使用环形玻璃搅拌棒是为了加快反应速率,减小实验误差 | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| C. | 用0.5 mol•L-1 NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 | |
| D. | 在测定中和热实验中需要使用的仪器有量筒、烧杯、酒精灯、温度计等 |
7.某中学化学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关实验数据如下表:
请计算(写出计算过程):
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量.
0 171413 171421 171427 171431 171437 171439 171443 171449 171451 171457 171463 171467 171469 171473 171479 171481 171487 171491 171493 171497 171499 171503 171505 171507 171508 171509 171511 171512 171513 171515 171517 171521 171523 171527 171529 171533 171539 171541 171547 171551 171553 171557 171563 171569 171571 171577 171581 171583 171589 171593 171599 171607 203614
| 反应前 | 反应后 | ||
| 实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 134.4g | 10g | 141.1g | |
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量.