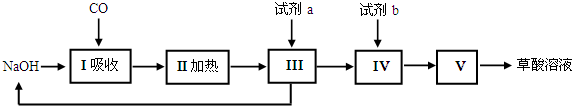
20.晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等,.以下是工业上制取纯硅的一种方法.

已知:在一定条件下可发生反应:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0
Ⅰ.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择a
(填序号字母),原因是因反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
a.520~530K b.1350~1360K
Ⅱ.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
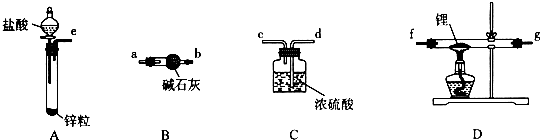
(1)现用如下装置(如图1)进行模拟反应②的过程.实验室制HCl的反应原理为:
2NaCl(s)+H2SO4(浓) QUOTE 2HCl↑+Na2SO4
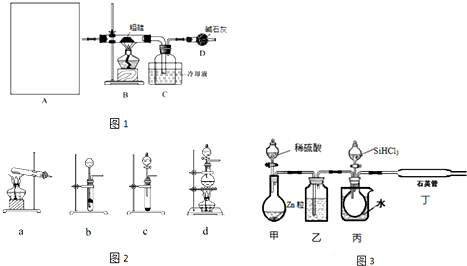
A中是HCl的发生装置,你认为应选择下列哪套装置?d(填装置的序号字母),装置D中碱石灰的作用为吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为分馏(填操作名称),下列不是该操作所需的仪器是(如图2)bd(填装置序号字母);
a.冷凝管 b.圆底烧瓶 c.蒸馏烧瓶 d.分液漏斗 e.温度计 f.接受器
(3)用SiHCl3与H2反应制备纯硅的装置如图3:
①按图示组装好仪器后,下列实验步骤的正确顺序为dbacef(填步骤的序号字母),
a.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
b.向装置中添加药品;
c.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
d.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为丙、丁(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是无尾气处理装置.

已知:在一定条件下可发生反应:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0
Ⅰ.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择a
(填序号字母),原因是因反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
a.520~530K b.1350~1360K
Ⅱ.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
2NaCl(s)+H2SO4(浓) QUOTE 2HCl↑+Na2SO4

A中是HCl的发生装置,你认为应选择下列哪套装置?d(填装置的序号字母),装置D中碱石灰的作用为吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为分馏(填操作名称),下列不是该操作所需的仪器是(如图2)bd(填装置序号字母);
a.冷凝管 b.圆底烧瓶 c.蒸馏烧瓶 d.分液漏斗 e.温度计 f.接受器
(3)用SiHCl3与H2反应制备纯硅的装置如图3:
①按图示组装好仪器后,下列实验步骤的正确顺序为dbacef(填步骤的序号字母),
a.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
b.向装置中添加药品;
c.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
d.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为丙、丁(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是无尾气处理装置.
11. S2Cl2是工业常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:
S2Cl2是工业常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:
①CS2+3Cl2 $\stackrel{95~100℃}{→}$ CCl4+S2Cl2; ②2S+Cl2$\stackrel{50~60℃}{→}$S2Cl2.
已知S2Cl2不稳定,在水中易发生歧化反应(一部分硫元素化合价升高,一部分硫元素化合价降低)反应设计的几种物质的熔、沸点如表:
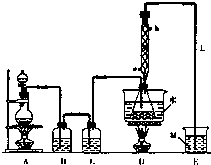
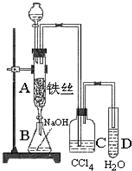
实验室利用如下装置制备S2Cl2(部分夹持仪器已略去),回答下列问题:
(1)写出A装置中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)D中冷凝管起到导气和冷凝双重作用,冷却水进水口是a(填“a”或“b”)下列均为中学教材中的实验.也可以采用类似D装置的冷凝方式的有I、Ⅱ、Ⅲ(填序号)
Ⅰ.石油分馏Ⅱ.制取溴苯Ⅲ.制取乙酸乙酯Ⅳ.制备氨气
(3)A部分仪器装配时,放好铁架台后,应先固定酒精灯(填仪器名称),整套装置装配完毕后,应先进行气密性检查,再添加试剂.实验完毕,A中不再产生氯气时,可拆除装置.拆除时,最先的操作应当是将E中长导管移开液面.
(4)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是:ClO-+2H++Cl-=Cl2↑+H2O(用离子方程式表示).
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,分离产品必需的主要玻璃仪器有蒸馏烧瓶;温度计(填两种仪器名称).
0 171358 171366 171372 171376 171382 171384 171388 171394 171396 171402 171408 171412 171414 171418 171424 171426 171432 171436 171438 171442 171444 171448 171450 171452 171453 171454 171456 171457 171458 171460 171462 171466 171468 171472 171474 171478 171484 171486 171492 171496 171498 171502 171508 171514 171516 171522 171526 171528 171534 171538 171544 171552 203614
 S2Cl2是工业常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:
S2Cl2是工业常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:①CS2+3Cl2 $\stackrel{95~100℃}{→}$ CCl4+S2Cl2; ②2S+Cl2$\stackrel{50~60℃}{→}$S2Cl2.
已知S2Cl2不稳定,在水中易发生歧化反应(一部分硫元素化合价升高,一部分硫元素化合价降低)反应设计的几种物质的熔、沸点如表:
| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | 一109 | 一23 | -77 |
(1)写出A装置中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)D中冷凝管起到导气和冷凝双重作用,冷却水进水口是a(填“a”或“b”)下列均为中学教材中的实验.也可以采用类似D装置的冷凝方式的有I、Ⅱ、Ⅲ(填序号)
Ⅰ.石油分馏Ⅱ.制取溴苯Ⅲ.制取乙酸乙酯Ⅳ.制备氨气
(3)A部分仪器装配时,放好铁架台后,应先固定酒精灯(填仪器名称),整套装置装配完毕后,应先进行气密性检查,再添加试剂.实验完毕,A中不再产生氯气时,可拆除装置.拆除时,最先的操作应当是将E中长导管移开液面.
(4)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是:ClO-+2H++Cl-=Cl2↑+H2O(用离子方程式表示).
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,分离产品必需的主要玻璃仪器有蒸馏烧瓶;温度计(填两种仪器名称).




 某化学课外小组用如图装置制取溴苯.
某化学课外小组用如图装置制取溴苯.