8.25℃时,下列各组离子在指定溶液中可能大量共存的是( )
| A. | 无色溶液中:Al3+、NH4+、Cl-、S2- | |
| B. | 由水电离得到的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NH4HCO3溶液中:K+、Na+、AlO2-、Cl- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- |
7. 某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4是一种有机羧酸,常用作除锈剂,该分子中B的杂化方式为sp2;1mol A2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等(任写一种).
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
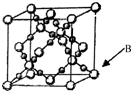
(6)BD2在高温高压下所形成晶体的晶胞如右图所示.一个该晶胞中含16个D原子.
 某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小 |
| B | 原子核外有三种不同的能量的原子轨道且各个轨道所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)B、C、D第一电离能由小到大为N>O>C.
(2)E的二价离子的电子排布式为1s22s22p63s23p63d9.
(3)A2B2D4是一种有机羧酸,常用作除锈剂,该分子中B的杂化方式为sp2;1mol A2B2D4分子中含有σ键数目为7×6.02×1023.
(4)与化合物BD互为等电子体的阴离子化学式为CN-等(任写一种).
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(6)BD2在高温高压下所形成晶体的晶胞如右图所示.一个该晶胞中含16个D原子.
6.下列反应的离子方程式书写正确的是( )
| A. | 用氨水吸收过量SO2气体:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | FeI2溶液中通入C12至Fe2+恰好完全被氧化:2Fe2++C12═2Fe3++2C1- | |
| C. | NH4HCO3溶液与过量的NaOH溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 将1 mol•L-1 NaAlO2溶液和1.5 mol•L-1的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
5.下列各组离子,在指定的环境中一定能大量共存的是( )
| A. | 在pH=0的溶液中:Fe2+、Mg2+、SO42-、NO3- | |
| B. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常温下c(H+)/c(OH-)=1012的溶液:Fe3+、Mg2+、NO3-、Cl- | |
| D. | 不能使酚酞变红的无色溶液:Na+、CO32-、K+、ClO-、AlO2- |
4.下列结论正确的是( )
①微粒半径:S2->Cl>S>F
②氢化物稳定性:HF>HCl>H2S
③离子还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4
⑥非金属性:F>Cl>S.
①微粒半径:S2->Cl>S>F
②氢化物稳定性:HF>HCl>H2S
③离子还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4
⑥非金属性:F>Cl>S.
| A. | ②④⑥ | B. | ①③④ | C. | 只有① | D. | 只有⑥ |
3.关于镁和铝的叙述正确的是( )
| A. | 镁、铝在常温下都能被氧气氧化 | B. | 镁、铝均须密封保存 | ||
| C. | MgO和Al2O3都是碱性氧化物 | D. | 镁铝合金的硬度比镁小 |
2.将铁条插入下列溶液中,不会发生反应的是( )
| A. | 稀硫酸 | B. | 稀盐酸 | C. | 硝酸铜 | D. | 氢氧化钠 |
1.将一小块铝片加人某盐酸溶液中,铝片完全溶解,在所得溶液中继续滴加NaOH溶液.生成Al(OH)3的量与加入的NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
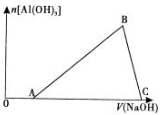

| A. | 盐酸与铝片反应后,盐酸还有剩余 | |
| B. | 图中B点之前发生的离子反应为Al3++3OH-═Al(OH)3↓ | |
| C. | A→B段消耗的NaOH体积与B→C段消耗的Na 0 H体积比≥3:1 | |
| D. | 溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等 |
20.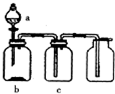 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )| 选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
| A | 稀盐酸 | 铁粉 | H2O | 制备并收集H2 |
| B | 稀硫酸 | Na2SO3粉末 | 浓硫酸 | 制备并收集干燥的SO2 |
| C | 浓盐酸 | KmnO4粉末 | NaOH溶液 | 制备并收集Cl2 |
| D | 浓氨水 | 生石灰 | 碱石灰 | 制备并收集干燥的NH3 |
| A. | A | B. | B | C. | C | D. | D |
19.某同学在家自制“84消毒液”,他根据84消毒液标签上的配方,用NaC1O固体配制480mL质量分数为25%的、密度为1.19g/cm3的NaC1O消毒液.下列说法正确的是( )
0 171258 171266 171272 171276 171282 171284 171288 171294 171296 171302 171308 171312 171314 171318 171324 171326 171332 171336 171338 171342 171344 171348 171350 171352 171353 171354 171356 171357 171358 171360 171362 171366 171368 171372 171374 171378 171384 171386 171392 171396 171398 171402 171408 171414 171416 171422 171426 171428 171434 171438 171444 171452 203614
| A. | 容量瓶用蒸馏水洗净后需晾干才能使用 | |
| B. | 需称取NaC1O固体144g | |
| C. | 所配得NaC1O消毒液久置后会失效 | |
| D. | 8 4消毒液的消毒原理是利用了NaClO的强碱性 |