题目内容
4.下列结论正确的是( )①微粒半径:S2->Cl>S>F
②氢化物稳定性:HF>HCl>H2S
③离子还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4
⑥非金属性:F>Cl>S.
| A. | ②④⑥ | B. | ①③④ | C. | 只有① | D. | 只有⑥ |
分析 ①是微粒半径大小比较,电子层不同的,电子层越多半径越大;电子层相同的,质子数越多半径越小;具有相同核外电子排布的遵循径小序大的原则,据此判断;
②③④⑤⑥比较的是元素非金属性强弱,元素的非金属性越强,气态氢化物的稳定性越强,单质的氧化性越强,最高价氧化物对应水化物的酸性越强,原子得电子能量越强,对应离子的还原性越弱,据此解答.
解答 解:①S2->Cl>S三个电子层,F有两个电子层,所以前3种微粒半径大于后1种,然后再根据“径小序大”的原则判断顺序为:微粒半径:S2->S>Cl>F,故①正错误;
②非金属性由强到弱顺序:F>Cl>S,所以气态氢化物稳定性顺序:HF>HCl>H2S,故②正确;
③非金属性由强到弱顺序:Cl>Br>I,所以离子还原性:S2->I->Br->Cl-,故③错误;
④非金属性由强到弱顺序:Cl>S>Se>Te,所以氧化性顺序:Cl2>S>Se>Te,故④正确;
⑤非金属性由强到弱顺序:Cl>S,非金属性性越强,最高价氧化物对应水化物的酸性越强酸性:H2SO4<HClO4,故⑤错误;
⑥同周期左到右,非金属性增强,同主族,上到下,非金属性减弱,所以非金属性由强到弱顺序:F>Cl>S,故⑥正确;
故选A.
点评 本题考查了微粒半径大小的比较,元素非金属性强弱判断依据,题目难度不大,解题时关键是根据元素周期表和周期律判断出元素非金属性强弱.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.含有一个碳碳三键的炔烃,加氢后产物的键线式为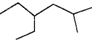 ,这种炔烃有( )
,这种炔烃有( )
 ,这种炔烃有( )
,这种炔烃有( )| A. | 1种 | B. | 3种 | C. | 5种 | D. | 7种 |
15.下列做法不正确的是( )
| A. | Na2O2用作呼吸面具的供氧剂 | B. | NaHCO3的热稳定性大于Na2CO3 | ||
| C. | 乙醇可与金属钠反应放出氢气 | D. | 金属钠着火时,用细沙覆盖灭火 |
19.某同学在家自制“84消毒液”,他根据84消毒液标签上的配方,用NaC1O固体配制480mL质量分数为25%的、密度为1.19g/cm3的NaC1O消毒液.下列说法正确的是( )
| A. | 容量瓶用蒸馏水洗净后需晾干才能使用 | |
| B. | 需称取NaC1O固体144g | |
| C. | 所配得NaC1O消毒液久置后会失效 | |
| D. | 8 4消毒液的消毒原理是利用了NaClO的强碱性 |
9.能正确表示下列反应的离子方程式是( )
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| B. | 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO${\;}_{4}^{-}$+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
16.煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出.目前我国采用的控制方法是电厂烟气脱硫.烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
Ⅰ、钠碱循环法脱硫技术.
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2═SO32-+H2O.
(2)NaOH溶液吸收SO的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
①由表判断,NaHSO3溶液显酸性,用化学平衡原理解释:溶液中存在HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,显酸性是因其电离大于其水解.
②当溶液呈中性时,离子浓度关系正确的是(选填字母):bc.
a.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c.c(Na+)=2c(SO32-)+c(HSO3-)
Ⅱ、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率.相关反应的热化学方程式如下:
CaSO4 (s)+CO (g)?CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)?CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s) 的热化学反应方程式3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJ•mol-1.
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp=$\frac{P(C{O}_{2})×P(S{O}_{2})}{P(CO)}$ (用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图(如图1所示)其中正确的是B.
(4)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数 的关系曲线.则降低该反应体系中产生的SO2生成量的措施有AB.

A、向该反应体系中投入生石灰 B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数 D、提高反应体系的温度.
Ⅰ、钠碱循环法脱硫技术.
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2═SO32-+H2O.
(2)NaOH溶液吸收SO的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是(选填字母):bc.
a.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c.c(Na+)=2c(SO32-)+c(HSO3-)
Ⅱ、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率.相关反应的热化学方程式如下:
CaSO4 (s)+CO (g)?CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)?CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s) 的热化学反应方程式3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJ•mol-1.
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp=$\frac{P(C{O}_{2})×P(S{O}_{2})}{P(CO)}$ (用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图(如图1所示)其中正确的是B.
(4)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数 的关系曲线.则降低该反应体系中产生的SO2生成量的措施有AB.

A、向该反应体系中投入生石灰 B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数 D、提高反应体系的温度.
13.下列化学反应中,属于氧化还原反应( )
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | NH3+HCl═NH4Cl | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O |
13.四种短周期元素在周期表中的位置如表,其中只有M元素原子最外层电子数与电子层数相等,下列说法不正确的是( )
| Y | Z | ||
| M | X |
| A. | 原子半径Z<M | |
| B. | 非金属性:X<Z | |
| C. | M元素最高价氧化物对应水化物具有两性 | |
| D. | Y的最高价氧化物对应水化物的酸性比X的弱 |