9.下列化学名词正确的是( )
| A. | 笨 | B. | 乙醇 | C. | 乙酸乙脂 | D. | 戍烷 |
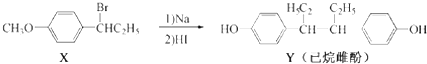
7.己烷雌酚的一种合成路线如下:
已知:连有四个不相同的原子或原子团的碳原子叫做手性碳原子.下列叙述正确的是( )

已知:连有四个不相同的原子或原子团的碳原子叫做手性碳原子.下列叙述正确的是( )
| A. | Y的分子式为C18H20O2 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| D. | 化合物Y中不含有手性碳原子 |
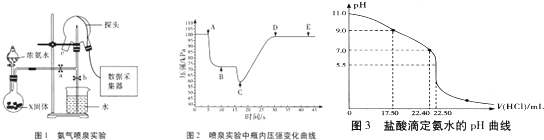
3.硫酸亚铁晶体( FeSO4•7H2O)俗称绿矾,加热至高温会发生分解,为确定绿矾分解产生的非金属氧化物,进行如下探究.
(1)假设1:非金属氧化物为SO2;
假设2:非金属氧化物为SO3;
假设3.非金属氧化物SO2、SO3.
(2)现设计如下所示实验装置(图中铁架台略去),检验绿矾的分解产物.

按上述装置进行实验,同学们观察到如下现象:
(3)结合实验现象,理论上分析可知绿矾分解还生成另一物质SO3.其理论依据是每两个FeSO4分解生成1个Fe2O3后剩余S、O原子个数比为2:5不等于1:2,若只生成Fe2O3和SO2,S和O之比为1:3.5,元素不守恒,故可通过理论分析得出:绿矾分解还生成另一物质SO3;.
(4)为证明反应产生了SO3,应在B、C之间补充一个装置,请你在下表中画出实验装置图(气流方向:左一右),注明药品的名称[可供选择的药品有1mol/L NaOH溶液、0.5mol/L BaCl2溶液、0.5mol/L Ba( N03)2溶液].
(5)根据上述实验,写出绿矾高温分解的化学方程式2FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$ Fe2O3+SO2↑+SO3↑+14H2O.
(1)假设1:非金属氧化物为SO2;
假设2:非金属氧化物为SO3;
假设3.非金属氧化物SO2、SO3.
(2)现设计如下所示实验装置(图中铁架台略去),检验绿矾的分解产物.

按上述装置进行实验,同学们观察到如下现象:
| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
(4)为证明反应产生了SO3,应在B、C之间补充一个装置,请你在下表中画出实验装置图(气流方向:左一右),注明药品的名称[可供选择的药品有1mol/L NaOH溶液、0.5mol/L BaCl2溶液、0.5mol/L Ba( N03)2溶液].
| 装置示意图 | 现象及结论 |
| 有白色沉淀生成说明分解产物SO3 |
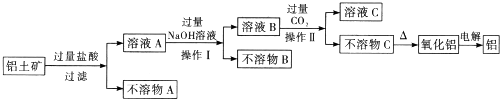
2.工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:
有关氢氧化物开始沉淀和沉淀完全的pH见下表
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条)搅拌、适当升温、将废渣碾细成粉末
(2)试剂A是H2O2(填化学式).
(3)调节酸浸液的pH的范围是3.7~5.4.
(4)滤液甲与试剂B发生置换反应,则试剂B是Zn(填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是坩埚.
0 171203 171211 171217 171221 171227 171229 171233 171239 171241 171247 171253 171257 171259 171263 171269 171271 171277 171281 171283 171287 171289 171293 171295 171297 171298 171299 171301 171302 171303 171305 171307 171311 171313 171317 171319 171323 171329 171331 171337 171341 171343 171347 171353 171359 171361 171367 171371 171373 171379 171383 171389 171397 203614

有关氢氧化物开始沉淀和沉淀完全的pH见下表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(2)试剂A是H2O2(填化学式).
(3)调节酸浸液的pH的范围是3.7~5.4.
(4)滤液甲与试剂B发生置换反应,则试剂B是Zn(填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是坩埚.

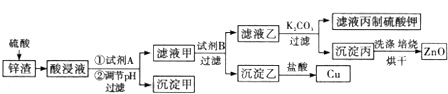
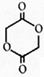 ;C中所含官能团的名称是羧基、溴原子.
;C中所含官能团的名称是羧基、溴原子.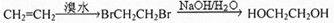 .
.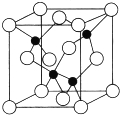 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题: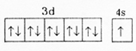 .
.