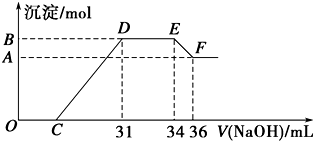
题目内容
2.工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示: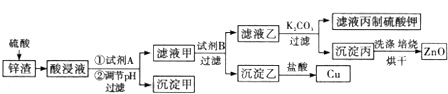
有关氢氧化物开始沉淀和沉淀完全的pH见下表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(2)试剂A是H2O2(填化学式).
(3)调节酸浸液的pH的范围是3.7~5.4.
(4)滤液甲与试剂B发生置换反应,则试剂B是Zn(填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是坩埚.
分析 ZnO、FeO、Fe2O3、CuO与硫酸反应生成硫酸锌、硫酸亚铁、硫酸铁以及硫酸铜,加入双氧水将二价铁离子氧化为三价铁离子,调节平衡pH使Fe(OH)3完全沉淀,到沉淀甲为氢氧化铁,加入试剂B锌,与硫酸铜反应得到铜单质;滤液乙为硫酸和硫酸锌,加入碳酸钾,与硫酸反应生成硫酸钾,同时得到沉淀丙Zn(OH)2,灼烧得到氧化锌.
解答 解:ZnO、FeO、Fe2O3、CuO与硫酸反应生成硫酸锌、硫酸亚铁、硫酸铁以及硫酸铜,加入双氧水将二价铁离子氧化为三价铁离子,调节平衡pH使Fe(OH)3完全沉淀,到沉淀甲为氢氧化铁,加入试剂B锌,与硫酸铜反应得到铜单质;滤液乙为硫酸和硫酸锌,加入碳酸钾,与硫酸反应生成硫酸钾,同时得到沉淀丙Zn(OH)2,灼烧得到氧化锌.
(1)搅拌、适当升温、将废渣碾细成粉末可加快反应速率,故答案为:搅拌、适当升温、将废渣碾细成粉末;
(2)双氧水与二价铁离子反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,使铁元素容易沉淀,且不引入新的杂质,故答案为:H2O2;
(3)使Fe(OH)3完全沉淀,其他离子不沉淀,pH:3.7~5.4,故答案为:3.7~5.4;
(4)B为锌,故答案为:Zn;
(5)焙烧固体用坩埚,故答案为:坩埚.
点评 本题为工艺流程题,难度较大,通过从废渣中提取氧化锌和金属铜的工艺流程考查了溶解平衡的移动、氧化还原方程式的书写、物质的分离等,熟悉物质的性质,清楚流程,是解题关键,侧重学生分析问题、解决问题能力的培养.

练习册系列答案
相关题目
7.己烷雌酚的一种合成路线如下:
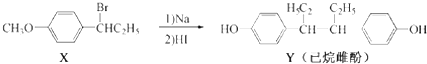
已知:连有四个不相同的原子或原子团的碳原子叫做手性碳原子.下列叙述正确的是( )

已知:连有四个不相同的原子或原子团的碳原子叫做手性碳原子.下列叙述正确的是( )
| A. | Y的分子式为C18H20O2 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| D. | 化合物Y中不含有手性碳原子 |
14.下列离子方程式书写正确的是( )
| A. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| B. | 硫酸氢铵溶液中加入过量氢氧化钠溶液:NH4++H++2OH-═H2O+NH3•H2O | |
| C. | 两极均用铁棒电解饱和食盐水:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| D. | 向Mg(HCO3)2溶液中加入过量的苛性钠溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O |
11.下列实验能达到目的是( )
| A. | 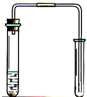 用铜和稀硝酸制取少量NO | |
| B. | 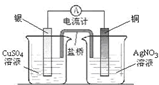 将化学能转化为电能 | |
| C. |  分离沸点相差较大的互溶液体混合物 | |
| D. | 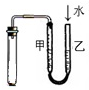 检验装置气密性 |
12.下列实验方案最合理的是( )
| A. | 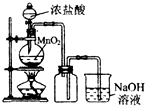 制备并收集Cl2 | B. |  制备氨气 | ||
| C. | 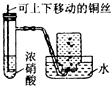 制备并收集NO2气体 | D. |  制备氧气 |
 和足量氢氧化钠溶液反应:
和足量氢氧化钠溶液反应: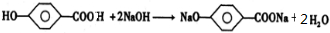
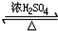 CH3OOCCOOCH3+2H2O
CH3OOCCOOCH3+2H2O .
.