15.在化工生产和科学研究中各种酸具有重要的用途.
(1)磷酸是一种三元中强酸,在溶液中各种含P粒子的百分数(δ)与溶液的pH关系如图:则磷酸的第二级电离平衡常数约为10-7;Na2HPO4溶液的pH约为10,说明HPO4-水解程度大于电离程度(用其电离与水解程度来解释),Na2HPO4溶液的物料守恒式为c(Na+)=2[c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)].
(2)乙酸(用HAC来表示)是一种重要的化工原料也可作溶剂.HClO4、HCl、HNO3、H2SO4在无水乙酸中都是弱酸,存在如下电离平衡(电离常数均为常温下的数值):
HClO4+HAC═H2AC++ClO4-K═1.6×10-5
HCl+HAC═H2AC++Cl-K═1.6×10-9
HNO3+HAC═H2AC++NO3-K═4.2×10-10
H2SO4+HAC═H2AC++HSO4-K═6.3×10-9
①H2AC+的名称为乙酸合氢离子;用乙酸作溶剂时,HClO4、HCl、HNO3、H2SO4的酸性由强到弱的排序为HClO4、H2SO4、HCl、HNO3;在0.01mol/L HNO3的乙酸溶液中,c(NO3-)=2×10-6(计算结果保留一位有效数字).
②已知如表酸在水中的电离常数(25℃)
则在相同条件下0.1mol/L HClO4的乙酸溶液与0.1 mol/L HAc水溶液导电能力最接近.
(3)混酸(浓硫酸和浓硝酸的混合物)是常用的硝化试剂,其中含有硝化反应的中间体NO2+,其反应是:2H2SO4+HNO3═[NO2]+[HSO4]-+[H3O+][HSO4]-.根据中和反应的原理判断此反应中HNO3作为碱;NO2+与CO2或N2O或N3-或-OCN(填化学式)的原子数和电子数相同、结构相似;H3O+的空间构型为三角锥形.
(1)磷酸是一种三元中强酸,在溶液中各种含P粒子的百分数(δ)与溶液的pH关系如图:则磷酸的第二级电离平衡常数约为10-7;Na2HPO4溶液的pH约为10,说明HPO4-水解程度大于电离程度(用其电离与水解程度来解释),Na2HPO4溶液的物料守恒式为c(Na+)=2[c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)].
(2)乙酸(用HAC来表示)是一种重要的化工原料也可作溶剂.HClO4、HCl、HNO3、H2SO4在无水乙酸中都是弱酸,存在如下电离平衡(电离常数均为常温下的数值):
HClO4+HAC═H2AC++ClO4-K═1.6×10-5
HCl+HAC═H2AC++Cl-K═1.6×10-9
HNO3+HAC═H2AC++NO3-K═4.2×10-10
H2SO4+HAC═H2AC++HSO4-K═6.3×10-9
①H2AC+的名称为乙酸合氢离子;用乙酸作溶剂时,HClO4、HCl、HNO3、H2SO4的酸性由强到弱的排序为HClO4、H2SO4、HCl、HNO3;在0.01mol/L HNO3的乙酸溶液中,c(NO3-)=2×10-6(计算结果保留一位有效数字).
②已知如表酸在水中的电离常数(25℃)
| 酸 | HCN | HAc | HF | H2SO3 |
| Ka | 4.9×10-10 | 1.75×10-5 | 3.5×10-4 | K1=1.5×10-2 |
(3)混酸(浓硫酸和浓硝酸的混合物)是常用的硝化试剂,其中含有硝化反应的中间体NO2+,其反应是:2H2SO4+HNO3═[NO2]+[HSO4]-+[H3O+][HSO4]-.根据中和反应的原理判断此反应中HNO3作为碱;NO2+与CO2或N2O或N3-或-OCN(填化学式)的原子数和电子数相同、结构相似;H3O+的空间构型为三角锥形.

13.已知:2Cu(IO3)2+24KI+□ ═2CuI↓+13I2+□K2SO4+□
═2CuI↓+13I2+□K2SO4+□ ,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )
,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )
 ═2CuI↓+13I2+□K2SO4+□
═2CuI↓+13I2+□K2SO4+□ ,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )
,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )| A. | $\frac{n}{10}$ mol | B. | $\frac{n}{11}$ mol | C. | $\frac{n}{12}$ mol | D. | $\frac{n}{13}$ mol |
12.有机电合成是合成一系列重要有机化合物的“绿色合成法”.例如利用电合成方法可制取一种无毒、环保性能优异、用途广泛的化工原料碳酸二甲酯.碳酸二甲酯的资料如表,电解制备模拟装置如图:
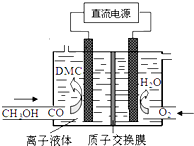 则下列说法正确的是( )
则下列说法正确的是( )
| 碳酸二甲酯资料 | |||||
| 简称 | 键线式 | 熔点 | 沸点 | 化学性质 | 用途 |
| DMC |  | 4℃ | 90.1℃ | 非常活泼、很易水解 毒性很低 | 有机合成中间体 |
 则下列说法正确的是( )
则下列说法正确的是( )| A. | 通O2区是阴极区,质子通过交换膜从阴极区移向阳极区 | |
| B. | 阳极反应:CO-2e-+2CH3OH═(CH3O)2CO+2H+ | |
| C. | 离子液体必须是水溶液,目的是传递电荷 | |
| D. | 电合成DMC的总反应方程式:CO+2CH3OH═(CH3O)2CO+H2 |
10.某稀溶液中含4mol KNO3和2.5mol H2SO4,向其中加入1.5mol Fe粉,充分反应后产生的NO气体在标准状况下的体积为( )
| A. | 36 L | B. | 28 L | C. | 22.4 L | D. | 11.2 L |
8.下表是A、B、C、D四种有机物的有关信息:
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体;②有毒;③不溶于水;④密度比水大;⑤与酸性KMnO4溶液和溴水反应褪色;⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O.
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应);其化学方程式为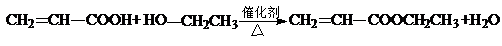 .
.
0 170996 171004 171010 171014 171020 171022 171026 171032 171034 171040 171046 171050 171052 171056 171062 171064 171070 171074 171076 171080 171082 171086 171088 171090 171091 171092 171094 171095 171096 171098 171100 171104 171106 171110 171112 171116 171122 171124 171130 171134 171136 171140 171146 171152 171154 171160 171164 171166 171172 171176 171182 171190 203614
| A | 1使溴的四氯化碳溶液褪色;②比例模型为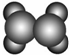 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | 1C、H两种元素组成;②球棍模型为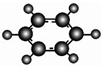 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
| D | ①由C、H、O三种元素组成;②球棍模型为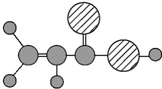 |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体;②有毒;③不溶于水;④密度比水大;⑤与酸性KMnO4溶液和溴水反应褪色;⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O.(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应);其化学方程式为


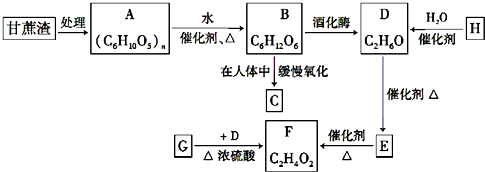
 ;
;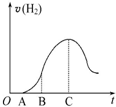 把放在空气中一段时间的5.0g铝片投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,回答下列问题:
把放在空气中一段时间的5.0g铝片投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,回答下列问题: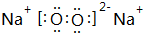 ,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.