题目内容
10.某稀溶液中含4mol KNO3和2.5mol H2SO4,向其中加入1.5mol Fe粉,充分反应后产生的NO气体在标准状况下的体积为( )| A. | 36 L | B. | 28 L | C. | 22.4 L | D. | 11.2 L |
分析 n(H+)=2.5mol×2=5mol,n(NO3-)=4,发生3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O或Fe+NO3-+4H+=Fe3++NO↑+2H2O,铁粉的物质的量为1.5mol,由离子方程式判断过量,以此计算该题.
解答 解:n(H+)=2.5mol×2=5mol,n(NO3-)=4,铁粉的物质的量为1.5mol,
由 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,
3 2 8
1.5mol 0.1mol 4mol,
则1.5molFe完全反应时,硝酸根离子与氢离子均过量,
则发生Fe+NO3-+4H+=Fe3++NO↑+2H2O,
若1.5molFe完全反应时,氢离子不足,则两个反应均发生,
Fe+NO3-+4H+=Fe3++NO↑+2H2O
x 4x x
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
y $\frac{8}{3}$y $\frac{2}{3}$y
则$\left\{\begin{array}{l}{x+y=1.5}\\{4x+\frac{8}{3}y=5}\end{array}\right.$,解得x=0.75mol,y=0.75mol
生成NO的体积为(0.75mol+0.75mol×$\frac{2}{3}$)×22.4L/mol=28L,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒为解答的关键,注意过量判断及发生的反应判断,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
20.下列化学方程式中不正确的是( )
| A. | CH3CH2CH2OH+HBr$→_{H+}^{△}$CH3CH2CH2Br+H2O | |
| B. | 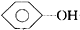 +NaHCO3→ +NaHCO3→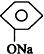 +H2CO3 +H2CO3 | |
| C. | 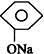 +CO2+H2O→ +CO2+H2O→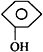 +NaHCO3 +NaHCO3 | |
| D. |  +3Br2→ +3Br2→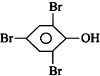 ↓+3HBr ↓+3HBr |
1.下列物质中属于纯净物的是( )
| A. | 冰水混合物 | B. | 水泥 | C. | 纯净的盐酸 | D. | 普通玻璃 |
5.下列说法不正确的是( )
| A. | 60周年国庆阅兵车HQE顶级红旗采用全铝车身,铝的氧化物属于两性氧化物 | |
| B. | 用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化 | |
| C. | 英国华裔科学家高锟因在“光在纤维中的传输应用于光学通信方面”做出了突破性成就,而获得了2009年诺贝尔物理学奖,光纤制品的基本原料为SiO2 | |
| D. | 液氨、液氯、液态氯化氢都是非电解质 |
15.在化工生产和科学研究中各种酸具有重要的用途.
(1)磷酸是一种三元中强酸,在溶液中各种含P粒子的百分数(δ)与溶液的pH关系如图:则磷酸的第二级电离平衡常数约为10-7;Na2HPO4溶液的pH约为10,说明HPO4-水解程度大于电离程度(用其电离与水解程度来解释),Na2HPO4溶液的物料守恒式为c(Na+)=2[c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)].
(2)乙酸(用HAC来表示)是一种重要的化工原料也可作溶剂.HClO4、HCl、HNO3、H2SO4在无水乙酸中都是弱酸,存在如下电离平衡(电离常数均为常温下的数值):
HClO4+HAC═H2AC++ClO4-K═1.6×10-5
HCl+HAC═H2AC++Cl-K═1.6×10-9
HNO3+HAC═H2AC++NO3-K═4.2×10-10
H2SO4+HAC═H2AC++HSO4-K═6.3×10-9
①H2AC+的名称为乙酸合氢离子;用乙酸作溶剂时,HClO4、HCl、HNO3、H2SO4的酸性由强到弱的排序为HClO4、H2SO4、HCl、HNO3;在0.01mol/L HNO3的乙酸溶液中,c(NO3-)=2×10-6(计算结果保留一位有效数字).
②已知如表酸在水中的电离常数(25℃)
则在相同条件下0.1mol/L HClO4的乙酸溶液与0.1 mol/L HAc水溶液导电能力最接近.
(3)混酸(浓硫酸和浓硝酸的混合物)是常用的硝化试剂,其中含有硝化反应的中间体NO2+,其反应是:2H2SO4+HNO3═[NO2]+[HSO4]-+[H3O+][HSO4]-.根据中和反应的原理判断此反应中HNO3作为碱;NO2+与CO2或N2O或N3-或-OCN(填化学式)的原子数和电子数相同、结构相似;H3O+的空间构型为三角锥形.
(1)磷酸是一种三元中强酸,在溶液中各种含P粒子的百分数(δ)与溶液的pH关系如图:则磷酸的第二级电离平衡常数约为10-7;Na2HPO4溶液的pH约为10,说明HPO4-水解程度大于电离程度(用其电离与水解程度来解释),Na2HPO4溶液的物料守恒式为c(Na+)=2[c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)].
(2)乙酸(用HAC来表示)是一种重要的化工原料也可作溶剂.HClO4、HCl、HNO3、H2SO4在无水乙酸中都是弱酸,存在如下电离平衡(电离常数均为常温下的数值):
HClO4+HAC═H2AC++ClO4-K═1.6×10-5
HCl+HAC═H2AC++Cl-K═1.6×10-9
HNO3+HAC═H2AC++NO3-K═4.2×10-10
H2SO4+HAC═H2AC++HSO4-K═6.3×10-9
①H2AC+的名称为乙酸合氢离子;用乙酸作溶剂时,HClO4、HCl、HNO3、H2SO4的酸性由强到弱的排序为HClO4、H2SO4、HCl、HNO3;在0.01mol/L HNO3的乙酸溶液中,c(NO3-)=2×10-6(计算结果保留一位有效数字).
②已知如表酸在水中的电离常数(25℃)
| 酸 | HCN | HAc | HF | H2SO3 |
| Ka | 4.9×10-10 | 1.75×10-5 | 3.5×10-4 | K1=1.5×10-2 |
(3)混酸(浓硫酸和浓硝酸的混合物)是常用的硝化试剂,其中含有硝化反应的中间体NO2+,其反应是:2H2SO4+HNO3═[NO2]+[HSO4]-+[H3O+][HSO4]-.根据中和反应的原理判断此反应中HNO3作为碱;NO2+与CO2或N2O或N3-或-OCN(填化学式)的原子数和电子数相同、结构相似;H3O+的空间构型为三角锥形.

19.用NA表示阿伏加德罗常数的值.下列说法错误的是( )
| A. | 室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2NA | |
| B. | 2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 2.3g金属钠与过量的氧气反应,无论是否加热,转移的电子数均为0.1NA | |
| D. | 1mol Na2CO3晶体中含有的CO32-离子数小于NA |
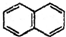 )结构
)结构 

 .
.