20.下列物质中加入NaOH溶液,不能得到澄清溶液的是( )
| A. | Al(OH)3 | B. | Al2O3 | C. | H2SiO3 | D. | MgCO3 |
18.如图是铝及其化合物的转化关系图(说明:NaAlO2即Na[Al(OH)4]),下列说法正确的是( )

0 170985 170993 170999 171003 171009 171011 171015 171021 171023 171029 171035 171039 171041 171045 171051 171053 171059 171063 171065 171069 171071 171075 171077 171079 171080 171081 171083 171084 171085 171087 171089 171093 171095 171099 171101 171105 171111 171113 171119 171123 171125 171129 171135 171141 171143 171149 171153 171155 171161 171165 171171 171179 203614

| A. | 图中所有的反应均为氧化还原反应 | |
| B. | 反应①②均为离子反应 | |
| C. | 反应②③都能产生氢气,且产生等量氢气消耗Al的质量和转移电子数分别相等 | |
| D. | 反应①②⑦中铝均作还原剂 |

 ;水杨酸与小苏打溶液反应的化学方程式:
;水杨酸与小苏打溶液反应的化学方程式: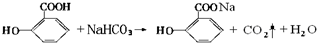 ;
;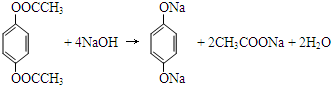 .
.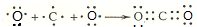 .
. ,其中存在的化学键有离子键、共价键.
,其中存在的化学键有离子键、共价键.
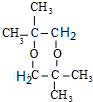 ,该分子的核磁共振氢谱有2种峰.
,该分子的核磁共振氢谱有2种峰. .F→G的反应:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.
.F→G的反应:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.
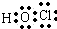 .家用消毒剂与洁厕剂(主要成分是含N的无氧酸)不宜混用,以防产生刺激性的有毒气体,请写出该反应的离子方程式:ClO-+Cl-+2H+═Cl2↑+2H2O
.家用消毒剂与洁厕剂(主要成分是含N的无氧酸)不宜混用,以防产生刺激性的有毒气体,请写出该反应的离子方程式:ClO-+Cl-+2H+═Cl2↑+2H2O .
.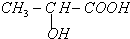 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.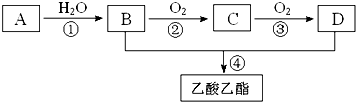
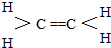 .
.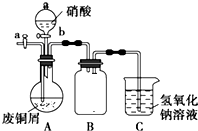 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如图:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如图: 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得: