7.常温下,下列各组物质中,B既能与A反应又能与C反应的是( )
| A | B | C | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
5.用铁酸钠(Na2FeO4)对自来水消毒是饮用水处理新技术,下列有关分析正确的是( )
| A. | 在Na2FeO4中Fe显+8价,具有强氧化性,所以能杀菌消毒 | |
| B. | 因为Na2FeO4溶液显碱性,所以能杀菌消毒 | |
| C. | Na2FeO4的还原产物为Fe3+,其易水解产生Fe(OH)3胶体,使水中悬浮物聚沉 | |
| D. | Na2FeO4的还原产物Fe2+ 水解,生成的胶体使水中悬浮物沉降,从而达到消毒目的 |
4.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法正确的是( )
| A. | X、M的原子能形成两种阴阳离子数目之比都为1:2的离子化合物 | |
| B. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| C. | 因为HW的酸性比H2YO3强,所以W的非金属性比Y强 | |
| D. | 只含M元素的物质就是M的单质 |
3.某溶液含有K+、Fe3+、SO42-、CO32-、I-中的几种.取样,滴加KSCN溶液后显血红色.为确定该溶液的组成,还需检验的离子是( )
| A. | K+ | B. | I- | C. | SO42- | D. | CO32- |
1.某物质灼烧时,焰色反应为黄色,下列判断正确的是( )
| A. | 该物质一定是钠的化合物 | B. | 该物质一定是金属钠 | ||
| C. | 该物质一定含钠元素 | D. | 该物质可能含钾元素 |
20.20gA物质和14gB物质恰好完全反应,生成8.8gC物质、3.6gD物质和0.2molE物质,则E物质的摩尔质量为( )
| A. | 100 g•mol-1 | B. | 108 g•mol-1 | C. | 55 g•mol-1 | D. | 96 g•mol-1 |
19.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( ) 

| A. | 4Fe(0H)2+O2+2H2O═4Fe(OH)3 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | 4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | D. | 2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ |
18.NA代表阿伏加德罗常数的值,下列有关叙述不正确的是( )
0 170972 170980 170986 170990 170996 170998 171002 171008 171010 171016 171022 171026 171028 171032 171038 171040 171046 171050 171052 171056 171058 171062 171064 171066 171067 171068 171070 171071 171072 171074 171076 171080 171082 171086 171088 171092 171098 171100 171106 171110 171112 171116 171122 171128 171130 171136 171140 171142 171148 171152 171158 171166 203614
| A. | 在熔融状态下,l mol Na2O2 完全电离出的离子数目为3 NA | |
| B. | 将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数$\frac{m{N}_{A}}{14}$ | |
| C. | 在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10NA | |
| D. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为 NA |
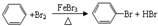 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应.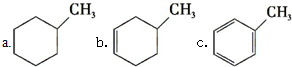
 c.
c.
