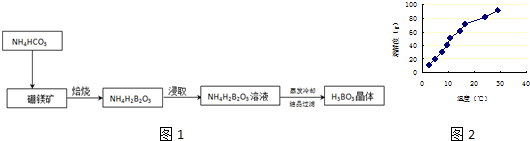
8. 苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理和实验主要装置甲如下:
苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理和实验主要装置甲如下:

已知:①甲苯为无色澄清液体,微溶于水,沸点110.6℃.
②苯甲酸的熔点为122.4℃.
③苯甲酸在25C和95°C时的溶解度分别为0.17g和6.8g.
实验流程:
I、往甲装置中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加人8.5g稍过量的
KMn04固体,控制反应温度约在1000C,回流反应4小时.
Ⅱ、将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加人浓盐
酸,经操作B得白色较干燥粗产品.
Ⅲ、纯度测定:称取1.220g白色样品,配成l00mL苯甲酸溶液,取25.00mL溶液,用0.1000mol•L-1
KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示:
请回答:
(1)仪器A的名称(球形)冷凝管,图甲冷水应从a(填“a“或“b“)管进人.
(2)判断甲苯被氧化完全的实验现象是甲苯层消失,回流液不再有明显的油珠
(3)根据实验过程B,回答下列两个问题:
①操作B的名称过滤
②如果滤液呈紫色,要先加亚硫酸氢钾,然后再加人浓盐酸酸化,加亚硫酸氢钾的目的是将过量的KMnO4反应掉,防止其与浓盐酸反应
(4)实验所得的苯甲酸在结晶过程中常裹携KC1析出.
①结合题中所给苯甲酸的性质,设计检验苯甲酸固体中KC1的实验方案:取适量样品加热水溶解后,冷却过滤得滤液(或取上层清液),向滤液中滴加硝酸酸化的硝酸银溶液,若得到白色沉淀,则可证明样品中含有KCl
②除去产品中KCl的实验方法的名称是重结晶
(5)样品中苯甲酸纯度为96.00%.
 苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理和实验主要装置甲如下:
苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理和实验主要装置甲如下:
已知:①甲苯为无色澄清液体,微溶于水,沸点110.6℃.
②苯甲酸的熔点为122.4℃.
③苯甲酸在25C和95°C时的溶解度分别为0.17g和6.8g.
实验流程:
I、往甲装置中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加人8.5g稍过量的
KMn04固体,控制反应温度约在1000C,回流反应4小时.
Ⅱ、将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加人浓盐
酸,经操作B得白色较干燥粗产品.
Ⅲ、纯度测定:称取1.220g白色样品,配成l00mL苯甲酸溶液,取25.00mL溶液,用0.1000mol•L-1
KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)仪器A的名称(球形)冷凝管,图甲冷水应从a(填“a“或“b“)管进人.
(2)判断甲苯被氧化完全的实验现象是甲苯层消失,回流液不再有明显的油珠
(3)根据实验过程B,回答下列两个问题:
①操作B的名称过滤
②如果滤液呈紫色,要先加亚硫酸氢钾,然后再加人浓盐酸酸化,加亚硫酸氢钾的目的是将过量的KMnO4反应掉,防止其与浓盐酸反应
(4)实验所得的苯甲酸在结晶过程中常裹携KC1析出.
①结合题中所给苯甲酸的性质,设计检验苯甲酸固体中KC1的实验方案:取适量样品加热水溶解后,冷却过滤得滤液(或取上层清液),向滤液中滴加硝酸酸化的硝酸银溶液,若得到白色沉淀,则可证明样品中含有KCl
②除去产品中KCl的实验方法的名称是重结晶
(5)样品中苯甲酸纯度为96.00%.
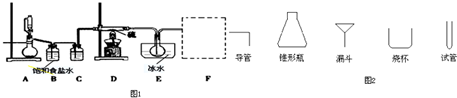
7.某实验小组用图2所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)反应原理(图1):

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
(1)仪器A的名称是分液漏斗.
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:温度过高,导致HNO3大量挥发.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合物$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物→(操作2)\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无极混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
0 170932 170940 170946 170950 170956 170958 170962 170968 170970 170976 170982 170986 170988 170992 170998 171000 171006 171010 171012 171016 171018 171022 171024 171026 171027 171028 171030 171031 171032 171034 171036 171040 171042 171046 171048 171052 171058 171060 171066 171070 171072 171076 171082 171088 171090 171096 171100 171102 171108 171112 171118 171126 203614

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:温度过高,导致HNO3大量挥发.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合物$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物→(操作2)\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无极混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
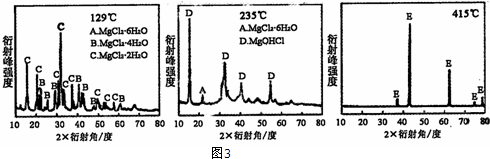
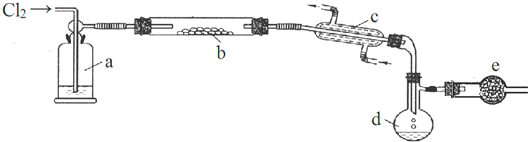
 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.
 NO2+3H2$\stackrel{140℃}{→}$
NO2+3H2$\stackrel{140℃}{→}$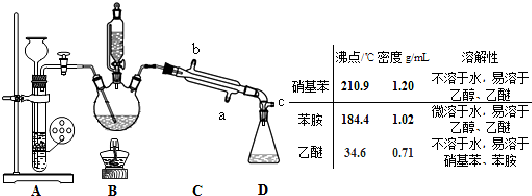
 +4MnO2+5H2SO4→2
+4MnO2+5H2SO4→2 +4MnSO4+1(NH4)2SO4+4H2O.
+4MnSO4+1(NH4)2SO4+4H2O.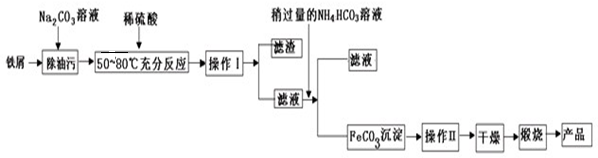

 ;
;