8.Na2SO3?7H20晶体加热脱水后,强热过程中质量不变.待固体冷却后溶于水,溶液的碱性比Na2SO3溶液强,所得固体成分可能是( )
| A. | Na2S Na2O Na2SO3 | B. | Na2SO4Na2O Na2SO3 | ||
| C. | Na2O Na2S Na2SO4 | D. | Na2S Na2SO3 |
6.下列叙述正确的是( )
| A. | 黄铜属于合金,硬度比纯铜高 | |
| B. | MgO、Al2O3是耐高温材料,工业上常用其电解冶炼对应的金属 | |
| C. | 与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物 | |
| D. | 金属单质与盐溶液的反应都是置换反应 |
5.已知标准状况下11.2L的某气体分子的质量为22g,则该气体的摩尔质量是( )
| A. | 44g | B. | 22g | C. | 44g/mol | D. | 22g/mol |
3.只用水不能鉴别的一组物质是( )
| A. | 苯和四氯化碳 | B. | 乙酸乙酯和乙醇 | C. | 乙醇和乙酸 | D. | 苯和溴苯 |
2.在一定条件下,对于密闭容器中的反应:N2+3H2?2NH3,下列说法正确的是( )
| A. | 增加N2的量,可以加快反应速率 | |
| B. | 当N2和H2全部转化为NH3时,反应才达到最大限度 | |
| C. | 达到平衡时,H2和NH3的浓度比一定为3:2 | |
| D. | 分别用N2和NH3来表示该反应的速率时,数值大小相同 |
1.下列说法中,正确的是( )
| A. | HCl气体溶于水形成盐酸,存在H+,所以HCl为离子化合物 | |
| B. | 含金属元素的离子一定是阳离子 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 稀有气体原子之间不易形成共价键 |
20.在体积一定的密闭容器中进行如下反应:A2(g)+2B2(g)?2C(g),已知A2、B2、C的起始浓度分别为a mol/L、b mol/L、0.3mol/L(非平衡态),在一定条件下,当反应达到平衡时,C的浓度为 0.5mol/L,则下列判断正确的是( )
| A. | 达平衡时,A2的正反应速率与B2的逆反应速率相等 | |
| B. | b≤0.2mol/L | |
| C. | 其它条件不变,在反应过程中使用了催化剂,可提高 A2、B2的转化率 | |
| D. | 该反应达平衡时气体物质的量浓度之和小于(a+b+0.3)mol/L |
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,用化学用语填空:
(1)元素②的原子结构示意图为 ,元素②原子核内含有6个中子的原子可表示为137N.
,元素②原子核内含有6个中子的原子可表示为137N.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4.
(3)元素①与⑥形成的化合物的电子式为: .
.
(4)⑤、⑥、⑨三种元素形成的简单离子,离子半径由大到小的顺序是S2->K+>Mg2+.
(5)实验室用元素③的氢化物制取③的单质的反应为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
0 170847 170855 170861 170865 170871 170873 170877 170883 170885 170891 170897 170901 170903 170907 170913 170915 170921 170925 170927 170931 170933 170937 170939 170941 170942 170943 170945 170946 170947 170949 170951 170955 170957 170961 170963 170967 170973 170975 170981 170985 170987 170991 170997 171003 171005 171011 171015 171017 171023 171027 171033 171041 203614
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,元素②原子核内含有6个中子的原子可表示为137N.
,元素②原子核内含有6个中子的原子可表示为137N.(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4.
(3)元素①与⑥形成的化合物的电子式为:
 .
.(4)⑤、⑥、⑨三种元素形成的简单离子,离子半径由大到小的顺序是S2->K+>Mg2+.
(5)实验室用元素③的氢化物制取③的单质的反应为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
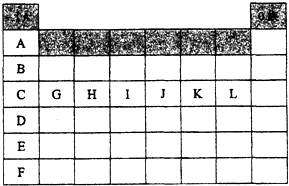 如图是元素周期表中各主族(A)及零族的部分元素符号代码(阴影处为族序数)
如图是元素周期表中各主族(A)及零族的部分元素符号代码(阴影处为族序数)