7.如图所示,下列叙述正确的是( )
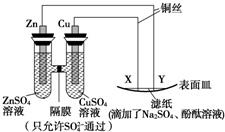

| A. | Y为负极,发生氧化反应 | B. | X为阴极,发生还原反应 | ||
| C. | Y与滤纸接触处变红 | D. | X与滤纸接触处有H2生成 |
6. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴中心是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成 Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉铁板,在铜铁接触处滴加NaCl溶液,则负极:Fe-2e-═Fe2+ |
5.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A. | 放电时正极反应式为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| B. | 充电时阳极反应式为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 放电时正极附近溶液的碱性增强 |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2SO2(g)+O2(g)?2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 | |
| B. | 已知C(s,石墨)═C(s,金刚石)△H>0,则金刚石比石墨稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则任何酸碱中和反应的热效应均为57.3 kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |
3.在2A(g)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | v(A)=0.6 mol/(L•s) | B. | v (B)=0.4mol/(L•s) | C. | v (C)=0.9 mol/(L•s) | D. | v (D)=1 mol/(L•s) |
20.下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A. | Fe(OH)3胶体、白磷、石灰乳 | B. | 干冰、铁、氯化氢 | ||
| C. | 烧碱、液态氧、碘酒 | D. | 空气、氮气、明矾 |
18.现有一体积为V mL、密度为ρ g•cm-3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol•L-1,溶质的质量分数为W,下列表示式中不正确的是( )
0 170744 170752 170758 170762 170768 170770 170774 170780 170782 170788 170794 170798 170800 170804 170810 170812 170818 170822 170824 170828 170830 170834 170836 170838 170839 170840 170842 170843 170844 170846 170848 170852 170854 170858 170860 170864 170870 170872 170878 170882 170884 170888 170894 170900 170902 170908 170912 170914 170920 170924 170930 170938 203614
| A. | c=$\frac{1000Wρ}{M}$ | B. | m=$\frac{VρW}{10000}$ | C. | W%=$\frac{cM}{1000ρ}$% | D. | c=$\frac{1000m}{VM}$ |