题目内容
19.现用质量分数为98%、密度为1.84g•cm-3的浓H2SO4配制500mL 1.6mol/L的稀H2SO4.可供选择的仪器有:①玻璃棒 ②烧瓶③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:(1)上述仪器中,在配制稀H2SO4时用不到的有②⑦⑧(填代号).
(2)经计算,需浓H2SO4的体积为43.5.
现有①10mL ②50mL ③100mL三种规格的量筒,应选用的量筒是②(填代号).
(3)在配制过程中,其他操作都准确,下列操作中会造成硫酸物质的量浓度偏高的有①④⑦(填代号).
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水稀释浓H2SO4
③转移前,容量瓶中含有少量蒸馏水
④未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线.
分析 (1)根据配制一定物质的量浓度溶液的操作步骤选取实验仪器;
(2)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸溶液的体积;根据浓硫酸的体积选取量筒,注意所选量筒的容积应稍大于或等于量取溶液的体积;
(3)依据配制一定物质的量浓度溶液的操作步骤判断;分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度硫酸溶液的一般步骤有:量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、500mL容量瓶,所以用不到的仪器有烧瓶、托盘天平、药匙,故答案为:②⑦⑧;
(2)质量分数98%密度为1.84g•cm-3浓H2SO4的物质的量浓度=$\frac{1000×1.84×98%}{98}$=18.4mol/L;设需要浓硫酸溶液的体积为V,1.6mol•L-1×500ml=V×18.4mol/L,解得:V=43.5mL,应选择50mL量筒;
故答案为:43.5;②;
(3)①洗涤量取浓H2SO4后的量筒,应将洗涤液倒入废液缸,如果转移至容量瓶,会导致溶质的量偏多,则浓度偏高,故①正确;
②稀释时应将浓H2SO4直接倒入烧杯中的水中,如果操作颠倒,会导致浓度偏低,故②错误;
③若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故③错误;
④未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,待冷却后,溶液体积偏小,则浓度偏高,故④正确;
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出,吸出的不止是水,还有溶质,则导致浓度偏小,故⑤错误;
⑥定容摇匀后,发现液面低于标线是正常的,又用胶头滴管加蒸馏水至标线会导致浓度偏偏低,故⑥错误;
⑦定容时,俯视标线,则溶液体积偏小,浓度偏高,故⑦正确.
故答案为:①④⑦.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案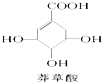
| A. | 分子式为C7H6O5 | |
| B. | 分子中含有三种官能团 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羧基和羟基均能电离出H+ |
| A. | 铜一锌原电池中,铜是原电池的阴极 | |
| B. | 用电解法精炼粗铜时,粗铜作阴极 | |
| C. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| D. | 电解稀硫酸制H2、O2时,铜作阳极 |
| A. | 新制氯水只含有氯分子和次氯酸分子 | |
| B. | 氯水光照时有气泡逸出,该气体的主要成分是氯气 | |
| C. | 氯水放置数天后,其酸性逐渐减弱 | |
| D. | 新制氯水可使紫色石蕊试液先变红后褪色 |
| A. | 已知2SO2(g)+O2(g)?2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 | |
| B. | 已知C(s,石墨)═C(s,金刚石)△H>0,则金刚石比石墨稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则任何酸碱中和反应的热效应均为57.3 kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |
| A. | Na与H2O反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 工业制备氯气:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2Na++2OH-+H2↑+Cl2↑ | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- |
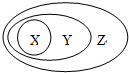 如图表示的一些物质或概念间的关系,下列与该关系一致的是( )
如图表示的一些物质或概念间的关系,下列与该关系一致的是( )