4.某同学学习过元素周期律、元素周期表后,为了探究同主族元素性质的递变规律,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该同学完成实验报告.
Ⅰ.实验目的:探究同一主族元素性质的递变规律.
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳.
仪器:(1)试管;(2)胶头滴管.(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
Ⅳ.实验结论:(3)Cl>Br>I.
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4)原子半径越大得电子能力越弱
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱.试列举一项事实说明F的非金属性比Cl强:(5)分别于氢气反应,F2更容易.
Ⅰ.实验目的:探究同一主族元素性质的递变规律.
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳.
仪器:(1)试管;(2)胶头滴管.(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4)原子半径越大得电子能力越弱
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱.试列举一项事实说明F的非金属性比Cl强:(5)分别于氢气反应,F2更容易.
2.某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入过量的10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.得到表1的数据:
表1
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为还应该增加一个实验,并补做如下实验:10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
D.利用上述实验数据即可计算:CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)的△H
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}×100%$(用代数式表示).
附表:溶解度表
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5g NaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入过量的10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.得到表1的数据:
表1
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)Na2CO3溶于水显碱性,其原因是CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解Na2CO3、NaHCO3固体都是全部溶解.
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为还应该增加一个实验,并补做如下实验:10mL密度约为1.1g/mL20%的盐酸,搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
D.利用上述实验数据即可计算:CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)的△H
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1 g混合物,加热至质量不变时,称其质量为m2 g,则原混合物中NaHCO3的质量分数为$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}×100%$(用代数式表示).
附表:溶解度表
| 溶解度 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
1.(1)实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$ TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:

有关物质的性质如下表:
仪器A的名称是干燥管.装置E中的试剂是浓硫酸.反应开始前依次进行如下操作:
组装仪器、检验装置气密性、加装药品,通N2一段时间后点燃酒精灯.反应结束后的操作包括:
①停止通N2②熄灭酒精灯③冷却至室温.正确的顺序为②③①(填序号).欲分离D中的液态混合物,所采用操作的名称是蒸馏.

有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
组装仪器、检验装置气密性、加装药品,通N2一段时间后点燃酒精灯.反应结束后的操作包括:
①停止通N2②熄灭酒精灯③冷却至室温.正确的顺序为②③①(填序号).欲分离D中的液态混合物,所采用操作的名称是蒸馏.
6.在一定条件下,氢气和丙烷完全燃烧的热化学方程式分别为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ•mol-1.5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则氢气和丙烷的体积比为( )
0 170706 170714 170720 170724 170730 170732 170736 170742 170744 170750 170756 170760 170762 170766 170772 170774 170780 170784 170786 170790 170792 170796 170798 170800 170801 170802 170804 170805 170806 170808 170810 170814 170816 170820 170822 170826 170832 170834 170840 170844 170846 170850 170856 170862 170864 170870 170874 170876 170882 170886 170892 170900 203614
| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 1:1 |
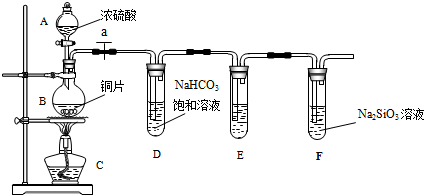
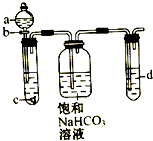 某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.
某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.

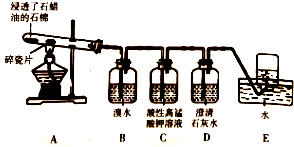 某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如图所示:
某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如图所示: (1)NO2-的定性检验:在酸性介质中,NO2-和Fe2+反应产生棕色的[Fe(NO)]2+(N为+2价),反应的离子方程式为2Fe2++NO2-+2H+═Fe3++[Fe(NO)]2++H2O.
(1)NO2-的定性检验:在酸性介质中,NO2-和Fe2+反应产生棕色的[Fe(NO)]2+(N为+2价),反应的离子方程式为2Fe2++NO2-+2H+═Fe3++[Fe(NO)]2++H2O.