11.下列物质中,属于天然高分子化合物的是( )
| A. | 脂肪 | B. | 纤维素 | C. | 氨基酸 | D. | 蔗糖 |
10.下列各组稀溶液:①氨水和硝酸银 ②氯化铝和氢氧化钠 ③硫酸氢铵和氢氧化钡 ④硝酸和碳酸钠.只用试管、滴管及闻气味就能鉴别的是( )
| A. | ③④ | B. | ①②④ | C. | ①②③④ | D. | ②④ |
9.下列离子方程式正确的是( )
| A. | 氯气和水的反应 Cl2+H2O═2H++Cl-+ClO- | |
| B. | 碳酸氢钠水解 HCO3-+H2O═H3O++CO32- | |
| C. | 碳酸钠水解 CO32-+2H2O═H2CO3+2OH- | |
| D. | 亚硫酸氢钠与过量的Ba(OH)2溶液 HSO3-+Ba2++OH-═BaSO3↓+H2O |
8.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中,不正确是( )
| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-10mol/L | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | 该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
4.固硫剂是把煤燃烧时生成的二氧化硫以盐的形式固定在炉渣中的物质,可减少二氧化硫对大气的污染.下列物质中可用做固硫剂的有( )
| A. | CaO | B. | P2O5 | C. | NH4NO3 | D. | Na2CO3 |
3.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
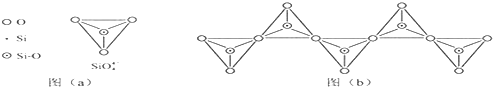
(6)在硅酸盐中,SiO44-四面体;如图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体;如图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.

2.下列叙述正确的是( )
0 170418 170426 170432 170436 170442 170444 170448 170454 170456 170462 170468 170472 170474 170478 170484 170486 170492 170496 170498 170502 170504 170508 170510 170512 170513 170514 170516 170517 170518 170520 170522 170526 170528 170532 170534 170538 170544 170546 170552 170556 170558 170562 170568 170574 170576 170582 170586 170588 170594 170598 170604 170612 203614
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 原子晶体中的相邻原子间可能存在极性共价键 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 金属晶体的熔点和沸点都很高 |

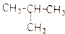 ⑥
⑥ ⑦
⑦
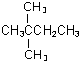 、
、 .
. .
.