14.关于电池,以下叙述不正确的是( )
| A. | 化学电池的反应本质是氧化还原反应 | |
| B. | 最早使用的化学电池是锌锰电池 | |
| C. | 最早使用的充电电池是铅蓄电池 | |
| D. | 二次电池的放电反应与充电反应可能是可逆反应 |
13.在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)?2C(g)下列说法中能说明这一反应已经达到化学平衡状态的是( )
| A. | 生成C的速率与C分解的速率相等 | |
| B. | A、B、C的浓度相等 | |
| C. | 单位时间生成n molA,同时生成3n molB | |
| D. | A、B、C的分子数之比为1:3:2 |
12.元素周期表和元素周期律对化学技术有很强的指导作用.以下叙述错误的是( )
| A. | 农药由含磷的有机物发展成为对人畜毒性较低的含砷有机物等 | |
| B. | 在周期表中金属与非金属的分界处,可以找到半导体材料,如硅、锗等 | |
| C. | 人们在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 利用周期表中相邻元素性质相似的规律,在周期表一定区域内寻找元素,发现物质的新用途被视为相当有效的方法 |
11.“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂.下列关于“对氨基苯甲酸丁酯”的说法中正确的是( )
| A. | 从有机物分类看,它可属于氨基酸类、酯类、芳香类 | |
| B. | 它能与盐酸反应,但不能与苛性钠溶液反应 | |
| C. | 甲酸丁酯基(-COOC4H9)有三种同分异构体 | |
| D. | 它的分子式为C11H15NO2 |
10.近期埃博拉病毒在非洲各国肆虐,严重威胁了非洲人民的生命.在此期间,环境消毒是极其关键的,常常喷洒一种名为“84”的消毒液,其有效成分为NaClO.下列有关“84”消毒液的说法正确的是( )
| A. | NaClO属于共价化合物 | |
| B. | “84”消毒液在空气中久置会变质 | |
| C. | 1L 0.1mol?L-1NaClO溶液中ClO-的数目为0.1NA | |
| D. | ClO-与Ca2+、Fe2+、Al3+ 能大量共存 |
9.将纯锌片和纯铜片按下图插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
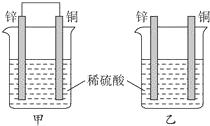

| A. | 两烧杯中溶液的pH值均增大 | B. | 产生气泡的速率甲比乙快 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲中铜片是正极,乙中锌片是负极 |
8.金刚石与石墨是碳的两种同素异形体,在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,下列说法正确的是( )
| A. | 金刚石比石墨稳定 | B. | 1mol石墨比1mol金刚石的总能量低 | ||
| C. | 石墨比金刚石稳定 | D. | 1mol石墨比1mol金刚石的总能量高 |
6.下列有关化学用语正确的是( )
| A. | -OH的电子式: | B. | 丁烷是键线式: | ||
| C. | 乙烯的结构简式:CH2=CH2 | D. | 最能反映甲烷真实结构的模型是: |
5.甲醇、天燃气是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇、甲烷.已知合成甲醇发生的主反应如下(已知CO的结构式为C≡O):
①CH3OH(g)?CO(g)+2H2(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
由此计算△H1=+99kJ•mol-1.已知△H2=-58kJ•mol-1,则△H3=-41kJ•mol-1.
(2)在容积为1.00L的容器中,通入一定量的甲醇发生反应①.100℃时,体系中各物质浓度随时间变化如图1所示(平衡时甲醇的转化率记作a1).

①在0-60s时段,反应速率v(CO)为0.001mol/(L•s)②;该反应的平衡常数K1 的计算式为$\frac{c(CO)c{\;}^{2}(H{\;}_{2})}{c(CH{\;}_{3}OH)}$.
②已知若在恒压条件下进行,平衡时CH3OH的转化率a2大于a1(填“大于”或“小于”、“等于”),判断理由是因为该反应为体积增大的反应,所以恒压相当于在恒容的基础上减小压强,平衡正向移动.
(3)合成CH4的原理:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1.其他条件相同,实验测得在T1和P1与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2,则P1>P2(填“>”、“<”或“=”).
(4)科学家用氮化镓材料与铜组装如图2所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4①写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O;.
②为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(选填“盐酸”或“硫酸”).
(5)标准状况下,将22.4L的甲烷完全燃烧生成的CO2通入到0.1L 1mol•L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
0 170310 170318 170324 170328 170334 170336 170340 170346 170348 170354 170360 170364 170366 170370 170376 170378 170384 170388 170390 170394 170396 170400 170402 170404 170405 170406 170408 170409 170410 170412 170414 170418 170420 170424 170426 170430 170436 170438 170444 170448 170450 170454 170460 170466 170468 170474 170478 170480 170486 170490 170496 170504 203614
①CH3OH(g)?CO(g)+2H2(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
回答下列问题:
(1)已知反应①中相关的化学键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)在容积为1.00L的容器中,通入一定量的甲醇发生反应①.100℃时,体系中各物质浓度随时间变化如图1所示(平衡时甲醇的转化率记作a1).

①在0-60s时段,反应速率v(CO)为0.001mol/(L•s)②;该反应的平衡常数K1 的计算式为$\frac{c(CO)c{\;}^{2}(H{\;}_{2})}{c(CH{\;}_{3}OH)}$.
②已知若在恒压条件下进行,平衡时CH3OH的转化率a2大于a1(填“大于”或“小于”、“等于”),判断理由是因为该反应为体积增大的反应,所以恒压相当于在恒容的基础上减小压强,平衡正向移动.
(3)合成CH4的原理:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162kJ•mol-1.其他条件相同,实验测得在T1和P1与T2和P2条件下该反应的H2平衡转化率相同,若T1>T2,则P1>P2(填“>”、“<”或“=”).
(4)科学家用氮化镓材料与铜组装如图2所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4①写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O;.
②为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(选填“盐酸”或“硫酸”).
(5)标准状况下,将22.4L的甲烷完全燃烧生成的CO2通入到0.1L 1mol•L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
 (1)键线式:
(1)键线式: 表示的分子式C6H14,名称是2-甲基戊烷;
表示的分子式C6H14,名称是2-甲基戊烷;