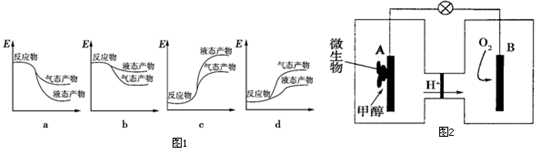
18.下列各组离子一定能大量共存的是( )
| A. | NH4+、H+、HCO3-、Cl- | B. | Fe3+、K+、CO32-、NO3- | ||
| C. | K+、Al3+、Cl-、OH- | D. | K+、Ba2+、NO3-、OH- |
17.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气.
已知:N2(g)+2O2(g)═N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
已知:N2(g)+2O2(g)═N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1076.7 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1059.3 kJ/mol |
14.X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,它们在周期表中的相对位置如表;X元素最低负化合价的绝对值与其原子最外层电子数相等;Z是地壳中含量最多的金属元素
(1)元素Q在周期表中的位置是第三周期ⅥA族,Z的离子结构示意图为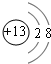 .
.
(2)W的最高价氧化物的化学式为P2O5,Y原子与氢原子构成的五核10电子微粒的电子式为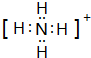 .
.
(3)X和氢可形成多种化合物分子,其中一种分子含18个电子,其分子式为C2H6.
(4)关于Y的气态氢化物甲:
①写出甲与Q的最高价氧化物对应水化物反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O.该反应的氧化剂是H2O2,当有0.1mol甲参加反应时,电子转移0.3 mol.
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为S4N4.
| X | Y | ||
| Z | W | Q |
 .
.(2)W的最高价氧化物的化学式为P2O5,Y原子与氢原子构成的五核10电子微粒的电子式为
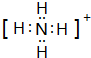 .
.(3)X和氢可形成多种化合物分子,其中一种分子含18个电子,其分子式为C2H6.
(4)关于Y的气态氢化物甲:
①写出甲与Q的最高价氧化物对应水化物反应的化学方程式2NH3+H2SO4=(NH4)2SO4.
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O.该反应的氧化剂是H2O2,当有0.1mol甲参加反应时,电子转移0.3 mol.
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为S4N4.
12. 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R<Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的氧化物既能与强酸反应又能与强碱反应 |
10.下列说法中,不正确的是( )
| A. | 天然气的主要成分是甲烷 | |
| B. | 将固体燃料粉碎可以提高燃料的燃烧效率 | |
| C. | 废弃的镍镉电池如不回收,会严重污染环境 | |
| D. | 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 |
9.下列说法或表示方法不正确的是( )
0 170251 170259 170265 170269 170275 170277 170281 170287 170289 170295 170301 170305 170307 170311 170317 170319 170325 170329 170331 170335 170337 170341 170343 170345 170346 170347 170349 170350 170351 170353 170355 170359 170361 170365 170367 170371 170377 170379 170385 170389 170391 170395 170401 170407 170409 170415 170419 170421 170427 170431 170437 170445 203614
| A. | 若形成化学键释放的能量大于断裂化学键所吸收的能量,则是放热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式可表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
 ;.
;.