题目内容
10.下列说法中,不正确的是( )| A. | 天然气的主要成分是甲烷 | |
| B. | 将固体燃料粉碎可以提高燃料的燃烧效率 | |
| C. | 废弃的镍镉电池如不回收,会严重污染环境 | |
| D. | 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 |
分析 A.天然气的主要成分是甲烷(CH4);
B.表面积增大,增大反应速率;
C.镉是重金属,有毒;
D.绿色化学的核心就是要利用化学原理从源头消除污染.
解答 解:A.甲烷是天然气的主要成分,故A正确;
B.表面积增大,增大反应速率,提高燃料的燃烧效率,故B正确;
C.镉是重金属,应集中处理,故C正确;
D.绿色化学的核心就是要利用化学原理从源头消除污染,不是对你环境进行无毒无害的治理,故D错误.
故选D.
点评 本题考查化石燃料与基本化工原料和环境污染,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
20.X、Y两元素是元素周期表中前20号元素,原子序数X比Y大,其简单离子的电子层结构相同.请判断下列说法正确的是( )
| A. | X和Y一定是不同周期元素,但可能是同一主族元素 | |
| B. | 若X和Y都为金属,则X的金属性比Y强 | |
| C. | 若X、Y的简单离子分别是aXm+和bYn-,则有a+m=b-n | |
| D. | 若X和Y都为非金属,则它们的氢化物的稳定性X比Y强. |
1.下列实验均发生了化学反应:①将铁钉放入CuSO4溶液中;②向FeSO4溶液中滴加稀硝酸;③将铜丝放入FeCl3溶液中.下列判断中,正确的是( )
| A. | 上述实验证明了氧化性:Fe3+>Fe2+>Cu2+ | |
| B. | 上述实验证明了Fe2+既有氧化性又有还原性 | |
| C. | 实验①中的化学反应是置换反应 | |
| D. | 向三个实验后的溶液中加入足量NaOH溶液振荡,最终都有Fe(OH)3生成 |
18.一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法正确的是( )
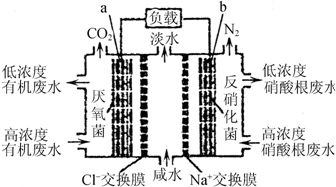

| A. | b电极上发生氧化反应 | |
| B. | b电极附近溶液的pH增大 | |
| C. | a电极反应式:C6H10O5+24e-+7H2O═6CO2↑+24H+ | |
| D. | 中间室:Na+移向左室,Cl-移向右室 |
2.下列叙述不正确的是( )
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 原电池中电流由正极流向负极,阳离子向正极移动 | |
| D. | 用惰性电极电解AgNO3溶液一段时间后,加入一定质量Ag粉,溶液能恢复原状 |
19. 如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列说法不正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列说法不正确的是( )
 如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列说法不正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列说法不正确的是( )| A. | 最简单气态氢化物的稳定性③比⑦小 | |
| B. | ①与④能形成原子个数比为1:1的化合物 | |
| C. | ⑤和⑥的最高价氧化物对应的水化物可以反应 | |
| D. | 原子半径②>③>④ |
20.对于mA(气)+nB(气)?pC(气)+qD(气)的平衡体系,当升高温度时,体系对氢气的相对密度从16.5变成16.9,则下列说法正确的是( )
| A. | m+n>p+q 正反应是放热反应 | B. | m+n>p+q 正反应是吸热反应 | ||
| C. | m+n<p+q 逆反应是放热反应 | D. | m+n=p+q 逆反应是吸热反应 |
 ,不可能具有的性质是( )
,不可能具有的性质是( )