18.下列说法正确的是( )
| A. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| B. | 用溴水鉴别苯和正己烷 | |
| C. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| D. | 乙烯和苯都能使溴水褪色,褪色的原因不相同 |
17.为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源,以下做法不能提高燃料效率的是( )
| A. | 煤的汽化与液化 | B. | 液体燃料呈雾状喷出 | ||
| C. | 将煤压成煤球使用 | D. | 将煤粉燃烧 |
16.下列说法正确的是( )
| A. | 有机化工原料乙烯可以通过石油分馏大量获得 | |
| B. | 通常情况下丙烷比丁烷更易液化 | |
| C. | 邻二甲苯有两种 | |
| D. | 2-甲基丙烯与1-丁烯不是同系物 |
15.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1 molAl3+含有的核外电子数为3NA | |
| B. | 将58.5g NaCl溶于1.00 L水中,所得NaCL溶液的浓度为1.00mol•L-1 | |
| C. | 1 molCl2与足量的铁反应,转移的电子为数3Na | |
| D. | 常温下,10LpH=1的硫酸溶液中含有的H+离子数为NA. |
14.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>HBr>HI | B. | 原子半径:Na>Mg>Al | ||
| C. | 还原性:PH3>H2S>HC1 | D. | 结合H+能力:CH3COO->HCO3->ClO- |
12.对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
| A. | 加适量的醋酸钠晶体后,两溶液的c(H+)均减小 | |
| B. | 使温度都升高20℃后,两溶液的c(H+)均不变 | |
| C. | 加水稀释2倍后,两溶液的c(H+)均增大 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气一样多 |
11.Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?Z(g).则下列说法一定正确的是( )
| A. | 若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ=Ⅱ | |
| B. | 若X、Y均为气态,则平衡时气体X的转化率:Ⅰ>Ⅱ | |
| C. | 若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间不相同 | |
| D. | 平衡时Ⅰ容器的体积小于VL |
10.氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等,用孔雀石[主要含Cu2(OH)2CO3,还含有少量Fe、Si的化合物]制备氯化铜晶体,方案如图:

已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
(1)酸溶时应选择酸的名称为盐酸;若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①可选用BE(填字母).
A.Cu B.Cl2 C.NH3•H2O D.NaOH E.H2O2 F.KMnO4
(2)加入试剂②的目的是调节pH至a,a的范围是3.7~5.4,写出试剂②的一种可能的化学式CuO、Cu(OH)2.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是蒸发浓缩、冷却结晶、过滤、用无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是防止CuCl2•xH2O晶体溶解损失.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是CuCl2•xH2O晶体加热时会发生水解.
②称取ag晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为bg.则x=$\frac{80a-135b}{18b}$(用含a、b的代数式表示).
0 170239 170247 170253 170257 170263 170265 170269 170275 170277 170283 170289 170293 170295 170299 170305 170307 170313 170317 170319 170323 170325 170329 170331 170333 170334 170335 170337 170338 170339 170341 170343 170347 170349 170353 170355 170359 170365 170367 170373 170377 170379 170383 170389 170395 170397 170403 170407 170409 170415 170419 170425 170433 203614

已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
| 离子种类 pH | Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀 | 2.7 | 5.4 | 8.1 |
| 沉淀完全 | 3.7 | 6.9 | 9.6 |
A.Cu B.Cl2 C.NH3•H2O D.NaOH E.H2O2 F.KMnO4
(2)加入试剂②的目的是调节pH至a,a的范围是3.7~5.4,写出试剂②的一种可能的化学式CuO、Cu(OH)2.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是蒸发浓缩、冷却结晶、过滤、用无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是防止CuCl2•xH2O晶体溶解损失.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是CuCl2•xH2O晶体加热时会发生水解.
②称取ag晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为bg.则x=$\frac{80a-135b}{18b}$(用含a、b的代数式表示).
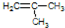 ,其系统命名为2-甲基-1-丙烯.
,其系统命名为2-甲基-1-丙烯.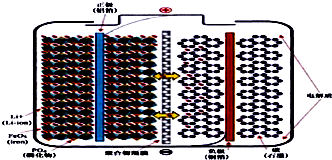 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4